题目内容
短周期元素X、Y的原子序数相差2.下列有关叙述正确的是( )
| A、X与Y可能形成XY化合物 |
| B、X与Y一定位于同一周期 |
| C、X与Y不可能位于同一主族 |
| D、X与Y都为主族元素 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y的原子序数相差2,可能为同周期的元素,如C与O,也可能为同一主族元素,如Li与H,可能即不同周期也不同主族,如Na与F;X和Y不一定都是主族元素,其中有一种可能为稀有气体元素,以此来解答.
解答:
解:A.短周期元素X、Y可能为C与O,可以形成共价化合物CO,故A正确;
B.两种元素不一定处于同一周期,如钠元素和氟元素,故B错误;
C.若短周期元素X、Y分别为Li与H,原子序数相差2,二者位于同一主族,故C错误;
D.若短周期元素X、Y可能有一种为稀有气体元素,如O和Ne,不一定都是主族元素,故D错误;
故选A.
B.两种元素不一定处于同一周期,如钠元素和氟元素,故B错误;
C.若短周期元素X、Y分别为Li与H,原子序数相差2,二者位于同一主族,故C错误;
D.若短周期元素X、Y可能有一种为稀有气体元素,如O和Ne,不一定都是主族元素,故D错误;
故选A.
点评:本题考查元素周期表由元素周期律的综合应用,题目难度中等,侧重于学生的分析能力的考查,为高考常见题型,熟悉常见元素的位置,可利用列举法进行解答.

练习册系列答案
相关题目
 如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )
如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )| A、原子半径:W>Y>Z |
| B、X的氢化物不如Z的氢化物稳定 |
| C、Y的氢化物比W的氢化物沸点高,是因为存在氢键 |
| D、常见的X的氢化物具有正四面体结构 |
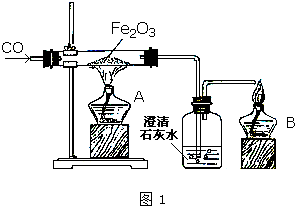 某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
 从A出发可发生如图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种.
从A出发可发生如图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种.