题目内容
1.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生224mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )| A. | 1.68g | B. | 4.48g | C. | 5.60g | D. | 无法计算 |
分析 反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,计算混合物中O原子物质的量,根据Cu元素守恒计算n(CuO),再根据O原子守恒计算n(Fe2O3),溶液后溶液中氯离子物质的量不变,根据电荷守恒计算n(Fe2+),再根据Fe原子守恒计算n(Fe),根据m=nM计算铁的质量.
解答 解:反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,
反应后剩余n(H+)=0.4mol/L×0.2L=0.08mol,原溶液中n(HCl)=4.4mol/L×0.1L=0.44mol,
参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即2n(H2O)+2×$\frac{0.224L}{22.4L/mol}$=0.44mol-0.08mol,解得n(H2O)=0.17mol,故混合物中n(O)=n(H2O)=0.17mol,
由铜元素守恒,则n(CuO)=n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
由O原子守恒:3n(Fe2O3)+n(CuO)=0.17mol,则n(Fe2O3)=0.05mol
由氯离子守恒:2n(Fe2+)+n(H+)=n(Cl-),则n(Fe2+)=$\frac{0.44mol-0.08mol}{2}$=0.18mol,
由Fe原子守恒,n(Fe)=n(Fe2+)-2n(Fe2O3)=0.18mol-0.05mol×2=0.08mol,
故混合物中Fe的质量为0.08mol×56g/mol=4.48g,
故选B.
点评 本题考查混合物计算,注意从溶液存在的离子判断物质反应的程度,注意利用守恒的方法计算,题目难度中等.

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | CS2的电子式为: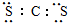 | B. | Ca2+的离子结构示意图为: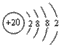 | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: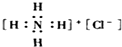 |
| A. | 两者都含s-s σ 键 | B. | 两者都含p-p σ 键 | ||
| C. | 前者含p-p σ 键,后者含s-p σ 键 | D. | 两者都含p-p π 键 |
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
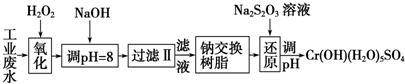
注:常温下,部分阳离子以氢氧化物形式完全沉淀时所需的pH,如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是CD
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程在酸性条件下进行,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至
10-5 mol•L-1.
| A. | BaCl2溶液 | B. | 稀硝酸和BaCl2溶液 | ||
| C. | 稀硫酸和BaCl2溶液 | D. | 稀盐酸和BaCl2溶液 |

