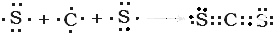题目内容
11.稀硝酸和铜反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(1)指出该氧化还原反应的氧化剂和还原剂,并用双线桥法表示出电子转移的方向和数目(在上面方程式中标出).
(2)若生成标准状况下11.2LNO气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量.
分析 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,该反应中转移6e-,生成标准状况下11.2LNO气体,n(NO)=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合电子守恒及原子守恒计算.
解答 解:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,Cu为还原剂,N元素的化合价由+5降低为+2价,硝酸为氧化剂,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 ,
,
答:氧化剂为硝酸,还原剂为Cu,双线桥法表示出电子转移的方向和数目为 ;
;
(2)生成标准状况下11.2LNO气体,n(NO)=$\frac{11.2L}{22.4L/mol}$=0.5mol,由电子守恒可知参加反应的铜的质量为$\frac{0.5mol×(5-2)}{(2-0)}$×64g/mol=48g,
由原子守恒可知被还原的HNO3的物质的量为0.5mol,
答:参加反应的铜的质量为48g,反应中被还原的HNO3的物质的量为0.5mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子和原子守恒为解答的关键,侧重分析与计算能力的考查,注意电子转移的表示方法,题目难度不大.

练习册系列答案
相关题目
3.通常用来衡量一个国家的石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 钢铁的产量 | D. | 硫酸的产量 |
1.下列关于钢铁腐蚀与防护的说法正确的是( )
| A. | 钢铁的吸氧腐蚀和析氢腐蚀的正极反应式均为:Fe-2e-═Fe2+ | |
| B. | 钢铁发生吸氧腐蚀时,负极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 地下钢管连接镁块防腐的方法为“牺牲阳极的阴极保护法” | |
| D. | 钢铁发生吸氧腐蚀时,钢铁制品的质量一定减轻 |
16.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
3.X、Y、Z、W四种元素在短周期中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径小 |
20.龙胆酸甲酯(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.正确的是( )
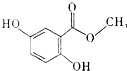

| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
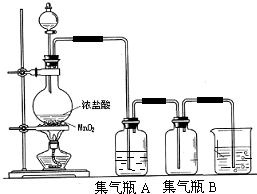 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取: 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: