题目内容
12.某炔烃与氢气加成得到2-甲基-3-乙基戊烷,该炔烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应;
根据加成原理采取逆推法还原C≡C,烷烃分子中相邻碳原子上至少均带2个氢原子的碳原子间是对应炔烃存在C≡C三键的位置;
还原三键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的2个氢原子形成三键,据此进行解答.
解答 解:给2-甲基-3-乙基戊烷中各C原子编号可得: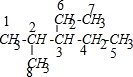 ,其中2、3号C上只含有1个H原子,无法添加碳碳三键,能够添加碳碳三键的碳原子为6、7和4、5,而这两个位置具有对称性,所以满足体积的炔烃的结构有1种,
,其中2、3号C上只含有1个H原子,无法添加碳碳三键,能够添加碳碳三键的碳原子为6、7和4、5,而这两个位置具有对称性,所以满足体积的炔烃的结构有1种,
故选A.
点评 本题考查了同分异构体的书写方法,题目难度不大,明确加成反应原理为解答关键,注意掌握同分异构体的概念及书写原则,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
3.X、Y、Z、W四种元素在短周期中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径小 |
20.龙胆酸甲酯(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.正确的是( )
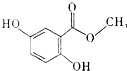

| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
7.下列推断合理的是( )
| A. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入氯水,氯水褪色后加热也能恢复原色 |
17.最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”使火星成为第二个地球的计划.下列有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 分子中三个碳原子以单键结合成链状 | |
| C. | C3F8与C3H8互为同分异构体 | |
| D. | 全氟丙烷的电子式为 |
4.下列说法正确的是( )
①1H、2H、3H为三种不同的核素;
②1H、2H、3H互为同位素;
③1H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子性质相同.
①1H、2H、3H为三种不同的核素;
②1H、2H、3H互为同位素;
③1H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子性质相同.
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
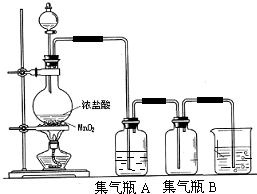 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取: 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: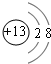 .
.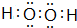 .离子半径T3+<R3-(填“>”、“<”、“=”)
.离子半径T3+<R3-(填“>”、“<”、“=”)