��Ŀ����
9��A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȣ�B��D��E����Ԫ�������ڱ������λ����ͼ����ʾ��ֻ��EԪ�صĵ�������ˮ��Ӧ���������ᣮ�ס��ҡ�M��W��X��Y��Z�������ʾ���A��B��D����Ԫ���е�һ�ֻ�����ɣ�����ֻ��M����ͬʱ��������Ԫ�أ�WΪN2H4���������ȼ�ϣ��ס���Ϊ�ǽ������ʣ�X�����к���10�����ӣ�����֮���ת����ϵ��ͼ����ʾ��
�ش��������⣺
��1���������ɱ�״����1.12L Y������9.025kJ��������д����Ӧ���Ȼ�ѧ����ʽN2��g��+O2��g��=2NO��g����H=+361kJ/mol��
��2��һ����E�ĵ�����NaOH��Һǡ����ȫ��Ӧ��������Һ��pHС��7������ڡ��������ڡ���С�ڡ�����ԭ����ClO-+H2O?HClO+OH-�������ӷ���ʽ��ʾ����
��3��W-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ��W-����ȼ�ϵ�طŵ�ʱ��������ӦʽΪO2+2H2O+4e-=4OH-��������ӦʽΪN2H4+4OH--4e-�TN2+4H2O��
��4����һ������A2��B2����������1L�ܱ������У���500�桢2��107 Pa�´ﵽƽ�⣮���ƽ������������ʵ���Ϊ0.50mol������A2Ϊ0.3mol��B2Ϊ0.1mol�����������A2��ƽ��ת����Ϊ33.3%�����¶��µ�ƽ�ⳣ��Ϊ$\frac{100}{27}$��
���� A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȣ���֪Ԫ��A��H����Ԫ�������ڱ���λ�ã���֪B��Dλ�ڵڶ����ڣ�Eλ�ڵ������ڣ���EԪ�صĵ�������ˮ��Ӧ���������ᣬ��EΪCl������֪BΪNԪ�ء�DΪOԪ�أ�
�ס��ҡ�M��W��X��Y��Z�������ʾ���H��N��O����Ԫ���е�һ�ֻ�����ɣ�����WΪN2H4���ס���Ϊ�ǽ������ʣ�X���Ӻ���10�����ӣ����ת����ϵ��֪������O2������N2��X��H2O�����ο��Ƶ���Y��NO��Z��NO2��M��HNO3���ݴ˽��
��� �⣺A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȣ���֪Ԫ��A��H����Ԫ�������ڱ���λ�ã���֪B��Dλ�ڵڶ����ڣ�Eλ�ڵ������ڣ���EԪ�صĵ�������ˮ��Ӧ���������ᣬ��EΪCl������֪BΪNԪ�ء�DΪOԪ�أ�
�ס��ҡ�M��W��X��Y��Z�������ʾ���H��N��O����Ԫ���е�һ�ֻ�����ɣ�����WΪN2H4���ס���Ϊ�ǽ������ʣ�X���Ӻ���10�����ӣ����ת����ϵ��֪������O2������N2��X��H2O�����ο��Ƶ���Y��NO��Z��NO2��M��HNO3��
��1�������͵������ɱ�״����1.12L NO������9.025kJ��������������2mol NO���յ�����Ϊ9.025kJ��$\frac{2mol��22.4L/mol}{11.2L}$=361kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽΪN2��g��+O2��g��=2NO��g����H=+361kJ/mol��
�ʴ�Ϊ��N2��g��+O2��g��=2NO��g����H=+361kJ/mol��
��2��һ����������NaOH��Һǡ����ȫ��Ӧ��õ���Ũ�ȵ�NaCl��NaClO��Һ����Һ�д������ˮ�⣺ClO-+H2O?HClO+OH-���ƻ�ˮ�ĵ���ƽ�⣬��Һ�ʼ��ԣ�������Һ��pHС��7��
�ʴ�Ϊ��С�ڣ�ClO-+H2O?HClO+OH-��
��3������������ԭ��Ӧ�������������õ��ӣ���������������OH-��������ӦʽΪ��O2+2H2O+4e-=4OH-����������������Ӧ��ʧȥ���ӣ��������������ɵ�����ˮ��������ӦʽΪ��N2H4+4OH--4e-�TN2+4H2O��
�ʴ�Ϊ��O2+2H2O+4e-=4OH-��N2H4+4OH--4e-�TN2+4H2O��
��4�����ƽ������������ʵ���Ϊ0.50mol������A2Ϊ0.3mol��B2Ϊ0.1mol����
3H2��g��+N2��g��?2NH3��g��
��ʼ��mol����0.45 0.15 0
ת����mol����0.15 0.05 0.1
ƽ�⣨mol����0.3 0.1 0.5-0.3-0.1=0.1
���������H2��ƽ��ת����Ϊ$\frac{0.15mol}{0.45mol}$��100%=33.3%��
�������Ϊ1L�������ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{0��{1}^{2}}{0��{3}^{3}��0.1}$=$\frac{100}{27}$
�ʴ�Ϊ��33.3%��$\frac{100}{27}$��
���� ���⿼��Ԫ�ػ������ƶϣ��漰�Ȼ�ѧ����ʽ��д������ˮ�⡢ԭ��ء���ѧƽ���йؼ���ȣ��ƶ�Ԫ���ǽ���ؼ�����Ҫѧ����������Ԫ�ػ�����ṹ�����ʡ����ջ�ѧƽ������ʽ���㣬�Ѷ��еȣ�

| A�� | ������������ʴ�����ⸯʴ��������Ӧʽ��Ϊ��Fe-2e-�TFe2+ | |
| B�� | ��������������ʴʱ��������ӦʽΪ��O2+2H2O+4e-�T4OH- | |
| C�� | ���¸ֹ�����þ������ķ���Ϊ������������������������ | |
| D�� | ��������������ʴʱ��������Ʒ������һ������ |
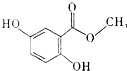
| A�� | ����ʽΪC8H6O4 | |
| B�� | ���е�̼ԭ�ӿ�����ͬһƽ���� | |
| C�� | �ܷ�����ȥ��Ӧ | |
| D�� | ÿĦ����������������4molH2��Ӧ |
| A�� | ����������̼ԭ�ӿ��ܴ���ͬһֱ���� | |
| B�� | ����������̼ԭ���Ե�����ϳ���״ | |
| C�� | C3F8��C3H8��Ϊͬ���칹�� | |
| D�� | ȫ������ĵ���ʽΪ |
��1H��2H��3HΪ���ֲ�ͬ�ĺ��أ�
��1H��2H��3H��Ϊͬλ�أ�
��1H��2H��3H��Ϊͬ�������壻
��114��Ԫ��λ�����ڱ���������VA�壻
����Ԫ��������Ϊ1��
��ͬλ�صġ�ͬλ��ָ���ص���������ͬ����Ԫ�����ڱ���ռ��ͬ��λ�ã�
��Ϊͬλ�ص�ԭ��������ͬ��
| A�� | �٢ڢޢ� | B�� | �٢ڢۢ� | C�� | �٢ڢ� | D�� | �٢ڢۢޢ� |
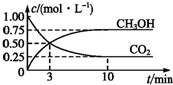 �������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ��ע��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��
�������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ��ע��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L�ĺ����ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��