题目内容
11.下列说法不正确的是( )| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
分析 A.配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液体积偏小;
B.酸式滴定管只能量取酸性溶液,且其感量为0.01mL;
C.洗涤沉淀的方法是向漏斗中加蒸馏水浸没沉淀,待水自然流出后;
D.蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌,防止局部受热温度过高.
解答 解:A.配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液体积偏小,根据c=$\frac{n}{V}$知,导致配制溶液浓度偏高,故A正确;
B.酸式滴定管只能量取酸性溶液,且其感量为0.01mL,硝酸银是强酸弱碱盐,其水溶液呈酸性,所以量取15.20mL AgNO3溶液可以用酸式滴定管,故B正确;
C.洗涤沉淀的方法是向漏斗中加蒸馏水浸没沉淀,待水自然流出后,不能用玻璃棒搅拌,否则滤纸破损,故C错误;
D.蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌,防止局部受热温度过高,从而溅出液体产生安全事故,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、仪器选取及误差分析,明确实验原理、实验基本操作、物质性质是解本题关键,注意安全事故的发生,易错选项是AC.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
19.将锌片和铜片按如图方式插入柠檬中,电流计指针发生偏转.则下列说法中正确的是( )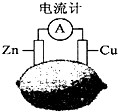

| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
16.实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30min,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
请回答:
(1)反应温度控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于,30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为水浴加热.
(2)加料完毕,保温30min,目的使反应充分进行.
(3)静置后只析出NaHCO3晶体的原因NaHCO3的溶解度最小.
(4)过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaCl(填化学式)循环使用,回收得到NH4Cl晶体.
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(1)反应温度控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于,30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为水浴加热.
(2)加料完毕,保温30min,目的使反应充分进行.
(3)静置后只析出NaHCO3晶体的原因NaHCO3的溶解度最小.
(4)过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaCl(填化学式)循环使用,回收得到NH4Cl晶体.
1.标准状态下,气态分子断开1mol化学键的焓变称为键焓.已知H-H、H-O和O═O键的键焓△H分别为436kJ•mol - 1、463kJ•mol - 1和495kJ•mol - 1.下列热化学方程式正确的是( )
| A. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=-485 kJ•mol - 1 | |
| B. | H 2O(g)═H 2(g)+$\frac{1}{2}$O 2(g)△H=+485 kJ•mol - 1 | |
| C. | 2H 2(g)+O 2(g)═2H 2O(g)△H=+485 kJ•mol - 1 | |
| D. | 2H 2(g)+O 2(g)═2H 2O(g)△H=-485 kJ•mol - 1 |
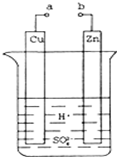 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得:
 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.