题目内容
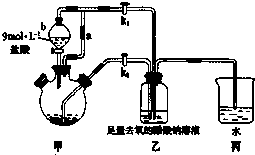
1.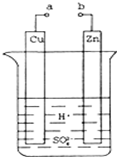 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:(1)a和b不连接时,烧杯中现象是锌片逐渐溶解,锌片上有气泡冒出.
(2)a和b用导线连接,Cu极为原电池正极(填“正”或“负”),电极反应式
为:2H++2e-=H2↑;溶液中H+移向Cu(填“Cu”或“Zn”)极.电池总反应式为:Zn+H2SO4=ZnSO4+H2↑.若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为21.6g.
分析 (1)a和b不连接时,烧杯中现象是锌片逐渐溶解,锌片上有气泡冒出;
(2)该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;根据锌和转移电子之间的关系式计算.
解答 解:(1)和b不连接时,烧杯中现象是锌片逐渐溶解,锌片上有气泡冒出,故答案为:锌片逐渐溶解,锌片上有气泡冒出;
(2)该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为2H++2e-=H2↑,电池总反应式为:Zn+H2SO4=ZnSO4+H2↑; 锌失电子发生氧化反应,电解质溶液中氢离子向正极Cu极移动,根据锌和转移电子之间的关系式得,消耗锌的质量=0.2mol,其质量为0.2mol×108g/mol=21.6g,
故答案为:正; 2H++2e-=H2↑; Cu;Zn+H2SO4=ZnSO4+H2↑; 21.6.
点评 本题考查了原电池原理及原电池设计,根据原电池反应特点、电极反应等知识点分析解答,铜锌原电池中电池反应式与锌发生化学腐蚀离子反应相同,题目难度不大.

练习册系列答案
相关题目
11.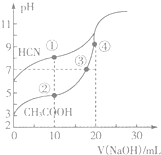 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )| A. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| B. | 点②溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 点③溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 点④溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
16.生产泡沫橡胶过程中,有如下一个反应:2H2O2=2H2O+O2↑.有关该反应的说法正确的是( )
| A. | 该反应是个放热反应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | H2O2仅为氧化剂 | |
| D. | H2O2既是氧化剂又是还原剂 |
11.下列说法不正确的是( )
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个.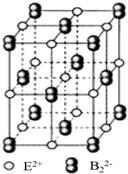 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.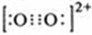 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA. .
.
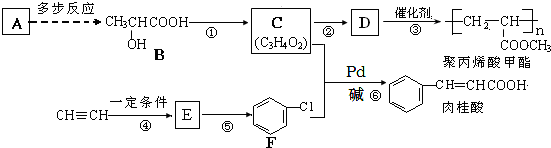
 (X为卤原子,R为取代基)
(X为卤原子,R为取代基) ;反式肉桂酸的结构简式为
;反式肉桂酸的结构简式为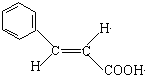 .
.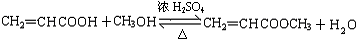 ;
;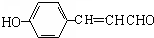 (写结构简式).
(写结构简式).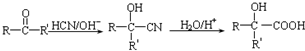 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):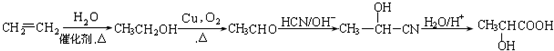 .
. 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).