题目内容
5. 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
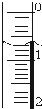
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色变为浅红色,并在半分钟内不褪色时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
分析 I.(1)溶液的稀释在烧杯中进行,溶液的定容在对应体积的容量瓶中进行;
(2)根据强碱滴定弱酸应选择碱性变色范围内的指示剂酚酞;
(3)根据碱溶液应盛放在碱式滴定管中;根据滴定管的结构与精确度来分析;
(4)滴定结束前溶液为无色,滴定结束时溶液变为浅红色,据此判断滴定终点;
Ⅲ.(1)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH溶液反应的关系式来解答;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:I.(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液,
故答案为:100mL容量瓶;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,
故答案为:酚酞;
(3)NaOH 溶液应盛放在碱式滴定管中;滴定管液面的读数0.60mL;
故答案为:碱式滴定管;0.60;
(4)酚酞遇到酸显无色,在弱碱溶液中显浅红色,则滴定终点时溶液从无色变为浅红色,所以滴定终点的现象为溶液由无色变为浅红色,并在半分钟内不褪色;
故答案为:溶液由无色变为浅红色,并在半分钟内不褪色;
Ⅲ.(1)第1次滴定误差明显大,应舍去,其他3次消耗的NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 0.1000mol/L×0.015L×40g/mol
x=0.450
样品总酸量为$\frac{0.450g}{0.01L}$=4.5g/100mL,
故答案为:4.5;
(2)a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故a正确;
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故b正确;
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)无影响,故c错误;
d.锥形瓶在滴定时距离摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故d正确;
故选:ab.
点评 本题主要考查了中和滴定操作、实验仪器的选择、误差分析等,难度中等,注意把握中和滴定实验的原理,注意根据浓度公式分析误差.

 阅读快车系列答案
阅读快车系列答案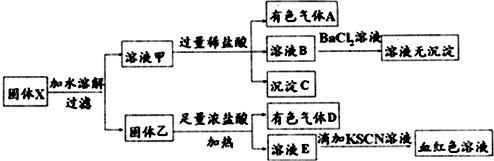
| A. | 溶液甲中一定含有K2SiO3、K2CO3,肯定不含MgCl2,可能含有K2SO3 | |
| B. | 为确定气体A组成,可先将气体通入品红溶液,再通过澄清石灰水 | |
| C. | 固体乙中肯定含有MnO2,可能含有FeO和Fe2O3中的至少一种 | |
| D. | 有色气体D可能是Cl2,也可能是Cl2、SO2的混合气体 |
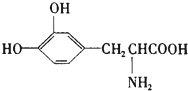 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下下列关于L-多巴胺的叙述不正确的是( )
| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100 mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol•L-1.
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
②铝无论与1.5mol/L硫酸还是3.0mol/L硫酸进行反应,与盐酸相比都无明显现象,根据以上铝与稀盐酸和稀硫酸反应差异,有人做出了一种假设或者猜想
假设或猜想一:Cl-能促进金属铝与H+的反应
假设或猜想二:SO42-对H+与金属铝的反应起阻碍作用
请将上述猜想补充完整,并验证.除上述试剂外,还有下列试剂可以选择:单质Mg、Na2SO4固体、NaCl固体、硝酸将上述没有明显反应的溶液中加入少量的NaCl固体,如果产生气泡,说明假设一成立
(2)试用简单的一种实验证明,在醋酸溶液中存在着:CH3COOH?H++CH3COO-的电离平衡.限制选试剂和用品:PH试纸、PH=2的醋酸溶液、醋酸钠固体、蒸馏水,仪器任选.写出简要操作、现象.(结论已经给你写好)将pH=2的溶液稀释100后,再测定其pH,若pH小于4,说明醋酸溶液中存在电离平衡说明醋酸溶液中存在电离平衡.
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1 mol-OH和1 molOH-所含电子数均为9NA | |
| C. | 密闭容器中1molNO与1molO2充分反应,产物的原子数为4NA | |
| D. | 标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA |