题目内容
17.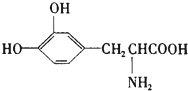 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下下列关于L-多巴胺的叙述不正确的是( )
| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
分析 A.含有羧基、氨基,且连接同一碳原子上,属于α-氨基酸;
B.含有酚羟基,具有酚的性质;
C.两分子通过形成2个肽键缩合形成分子式为C18H18O6N2;
D.酚羟基、羧基都能与氢氧化钠反应,只有氨基与HCl反应.
解答 解:A.含有羧基、氨基,且连接同一碳原子上,属于α-氨基酸,既具有酸性,又具有碱性,故A正确;
B.含有酚羟基,遇到Fe2(SO4)3溶液显紫色,故B正确;
C.两分子通过形成2个肽键缩合形成分子式为C18H18O6N2,含有肽键形成的六元环及2个苯环,有3个六元环,故C正确;
D.酚羟基、羧基都能与氢氧化钠反应,只有氨基与HCl反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为3:1,故D错误.
故选:D.
点评 本题考查有机物的结构与性质,涉及氨基酸与酚的性质,是有机化学基础常考题型,熟练掌握官能团的结构与性质.

练习册系列答案
相关题目
7.在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )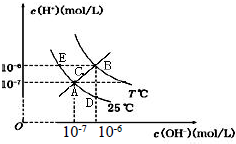

| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |
5.下列说法正确的是( )
| A. | 2012年,随着两会顺利召开,保障房建设成为热点.住宅建设离不开硅酸盐材料,工业玻璃、水泥、陶瓷都要使用石灰石做原料,钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 | |
| B. | 去年底,世界气候大会在南非德班召开.开发新型能源是践行低碳生活的有效途径之一,生物质能是指来源于动植物及其加工产品所储存的能量 | |
| C. | 近年食品安全倍受关注,某媒体披露“皮革奶”事件.有不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量.动物皮革的主要成分是蛋白质,“皮革奶”灼烧时有烧焦羽毛的气味 | |
| D. | 氯化钙及氯化镁等“化冰盐”是冰融化成水的反应催化剂,在雪地里加入化冰盐可快速消除冰雪 |
12.新版人民币的发行,引发了人们对有关人民币中化学知识的关注.下列表述不正确的是( )
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 用于人民币票面文字等处的油墨中所含有的氧化铁是一种磁性物质 | |
| C. | 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉 |
1. 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
(1)请写出该反应对应的离子方程式(提示:H2C2O4是弱酸):2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
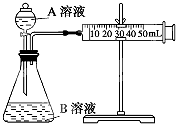
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
该实验探究的是温度、浓度、催化剂对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③>④>②>①(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验②中用KMnO4的浓度变化来表示该反应平均反应速率计算的表达式$\frac{4×1{0}^{-3}×0.01}{(4+2)×1{0}^{-3}×14}$mol•L-1•min-1(表达式中要用题中原始数据,无需算出结果,且假设混合溶液体积可以直接相加).若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?不可行(填“可行”或“不可行”).若不可行(若认为可行则下空不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量且同体积、不同浓度的草酸和同体积同浓度的酸性KMnO4溶液反应.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).(1)请写出该反应对应的离子方程式(提示:H2C2O4是弱酸):2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
8.某小组研究影响反应速率的因素..
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
②实验步骤:a)检查装置(图1)的气密性后,添加药品;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
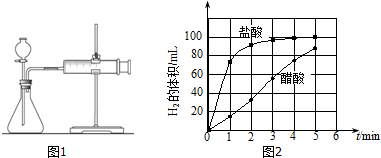
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
①完成上述反应原理的离子反应方程式S2O32-+2H+═S↓+H2O+SO2↑
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).

③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
5.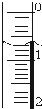 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色变为浅红色,并在半分钟内不褪色时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=4.5g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色变为浅红色,并在半分钟内不褪色时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
6.下列说法正确的是( )
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中NH4+、Al3+、NO3-、Cl-可以共存 | |
| B. | 氧化镁可以用作耐火材料 | |
| C. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| D. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |