题目内容
13.某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:①配制100mL 0.0400mol•L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是100 mL容量瓶、胶头滴管.
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
③用配制好的0.040 0mol•L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度.每次准确量取25.00mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定.滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,则KMnO4溶液的浓度为0.02mol•L-1.
分析 ①根据配制溶液的步骤和所用仪器即可判断;
②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好;
③令KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
解答 解:①配制100mL 0.0400mol•L-1的Na2C2O4溶液,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、量筒、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,该试验中两次用到玻璃棒,其作用分别是搅拌、引流,所以还必须用到的玻璃仪器是100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,
故答案为:反应生成的Mn2+对该反应有催化作用,且c(Mn2+)越大,催化效果越好;
③滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,消耗的KMnO4溶液的体积平均为是$\frac{20.00mL+19.80mL+20.20mL}{3}$=20mL,
n(C2O42-)=0.040 0mol•L-1×0.025=0.001mol,则:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.02L 0.001mol
所以2mol:5mol=c×0.02L:0.001mol,
解得c=0.02mol/L,
故答案为:0.02mol/L.
点评 本题考查溶液的配制、氧化还原反应配平、氧化还原反应滴定应用、化学计算等,难度中等,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  分散系的分类 | B. | 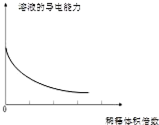 稀释浓氢氧化钠溶液的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴加盐酸 | D. |  向偏铝酸钠溶液中逐滴滴加盐酸 |
| A. | 2012年,随着两会顺利召开,保障房建设成为热点.住宅建设离不开硅酸盐材料,工业玻璃、水泥、陶瓷都要使用石灰石做原料,钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料 | |
| B. | 去年底,世界气候大会在南非德班召开.开发新型能源是践行低碳生活的有效途径之一,生物质能是指来源于动植物及其加工产品所储存的能量 | |
| C. | 近年食品安全倍受关注,某媒体披露“皮革奶”事件.有不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量.动物皮革的主要成分是蛋白质,“皮革奶”灼烧时有烧焦羽毛的气味 | |
| D. | 氯化钙及氯化镁等“化冰盐”是冰融化成水的反应催化剂,在雪地里加入化冰盐可快速消除冰雪 |
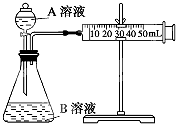 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素(化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O).(1)请写出该反应对应的离子方程式(提示:H2C2O4是弱酸):2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
| 序号 | T (K) | 催化剂用量(g) | A溶液 | B溶液 |
| ①① | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.001mol/L KMnO4溶液 |
| ②② | 298 | 0 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③③ | 323 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ④④ | 298 | 0.5 | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验序号 | 溶液褪色所需时间t(min) | ||
| 第一次 | 第二次 | 第三次 | |
| ①① | 6 | 7 | 7 |
| ②② | 14 | 11 | 14 |
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如下表,表中c=1.0 mol•L-1.
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的数据转化为曲线图(图2).
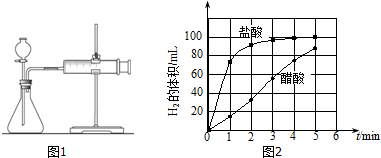
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(2)实验二:探究反应条件对0.10mol/L Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如下:
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
②上述实验①③是探究温度对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为5.0;乙是实验需要测量的物理量,则表格中“乙”应填写出现浑浊的时间/min.
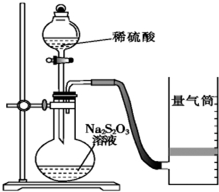 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+═H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是检查装置的气密性;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化 (写一种).
Ⅱ.为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表.
(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
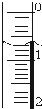 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.
如果液面位置如右图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色变为浅红色,并在半分钟内不褪色时,停止滴定,
并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=4.5g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab(填写序号)
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时距离摇动,有少量液体溅出.
| A. | 将乙酸乙酯与H218O混合后,用稀硫酸作催化剂,借以判断乙酸乙酯水解时分子中共价键的断裂情况,该方法应称为同位素示踪法 | |
| B. | 相对分子质量的测定常用质谱仪,分子结构测定方法主要是用红外光谱法 | |
| C. | C6H5-OH能与浓溴水生成三溴苯酚,甲苯却不能与浓溴水反应,说明苯酚分子中由于苯环影响,使羟基上H原子变得活泼 | |
| D. | 燃烧法是研究确定有机物成分的有效方法 |
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |