题目内容
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用过氧化氢和硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.84kJ?mol-1
在硫酸溶液中铜与过氧化氢反应生成铜离子和液态水的热化学方程式为: .
(3)控制其它条件相同,印刷电路板的金属粉末用10%过氧化氢溶液和3.0mol?L-1硫酸溶液处理,测得不同温度下铜的平均溶解速率(见表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 .
(4)在提纯后的硫酸铜溶液中加入一定量的亚硫酸钠和氯化钠溶液,加热,生成CuCl(CuCl难溶于水)的离子方程式是 .
(5)已知常温下氢氧化铜的溶度积常数Ksp=6×10-20,将50mL 0.01mol?L-1的硫酸铜溶液与50mL 0.04mol?L-1氢氧化钠溶液混合,充分反应后,溶液中铜离子的物质的量浓度为 .
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用过氧化氢和硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
| 1 |
| 2 |
在硫酸溶液中铜与过氧化氢反应生成铜离子和液态水的热化学方程式为:
(3)控制其它条件相同,印刷电路板的金属粉末用10%过氧化氢溶液和3.0mol?L-1硫酸溶液处理,测得不同温度下铜的平均溶解速率(见表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率[×10-3 mol?(L?min)-1] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
(4)在提纯后的硫酸铜溶液中加入一定量的亚硫酸钠和氯化钠溶液,加热,生成CuCl(CuCl难溶于水)的离子方程式是
(5)已知常温下氢氧化铜的溶度积常数Ksp=6×10-20,将50mL 0.01mol?L-1的硫酸铜溶液与50mL 0.04mol?L-1氢氧化钠溶液混合,充分反应后,溶液中铜离子的物质的量浓度为
考点:常见的生活环境的污染及治理,热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论,化学应用
分析:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据Ksp=c(Cu2+)?[c(OH-)]2=6×10-20计算.
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据Ksp=c(Cu2+)?[c(OH-)]2=6×10-20计算.
解答:
解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ?mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ?mol-1;
③H2(g)+
O2(g)═H2O(l)H3=-285.84KJ?mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×
+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×
+H3=64.39KJ?mol-1+(-196.46KJ?mol-1)×
+(-285.84KJ?mol-1)=-448.48KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-448.48KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(5)溶液混合后,不发生反应时c(Cu2+)=
×0.01mol?L-1=0.005mol?L-1、c(OH-)=
×0.04mol?L-1=0.02mol?L-1,令平衡时溶液中Cu2+的浓度为xmol/L,则;
Cu2++2OH-=Cu(OH)2↓
转化 0.005-x 0.01-2x
反应后溶液中c(OH-)=0.02mol/L-(0.01-2x)mol/L=(0.01+2x)mol/L,故Ksp=c(Cu2+)?[c(OH-)]2=6×10-20=x×(0.01+2x)2,由于0.01+2x≈0.01,解得x=6×10-16mol/L,故答案为:6×10-16mol/L.
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ?mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ?mol-1;
③H2(g)+
| 1 |
| 2 |
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×
| 1 |
| 2 |
由盖斯定律可知该反应的反应热△H=H1+H2×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-448.48KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(5)溶液混合后,不发生反应时c(Cu2+)=
| 1 |
| 2 |
| 1 |
| 2 |
Cu2++2OH-=Cu(OH)2↓
转化 0.005-x 0.01-2x
反应后溶液中c(OH-)=0.02mol/L-(0.01-2x)mol/L=(0.01+2x)mol/L,故Ksp=c(Cu2+)?[c(OH-)]2=6×10-20=x×(0.01+2x)2,由于0.01+2x≈0.01,解得x=6×10-16mol/L,故答案为:6×10-16mol/L.
点评:本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式、Ksp等高考中常考考点的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验能获得成功的是( )
| A、乙醇与2mol?L-1的硫酸溶液混合加热到170℃制乙烯 |
| B、苯与溴水反应制取溴苯 |
| C、要鉴别己烯中是否混有少量甲苯,最恰当的实验方法是先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| D、电石与饱和食盐水作用制乙炔 |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
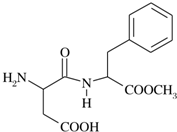 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.

 所含官能团的名称是
所含官能团的名称是 按要求完成下列问题:
按要求完成下列问题: ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为