题目内容
5.下列有关热化学方程式及其叙述正确的是( )| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则分解2mol吸收的热量应该为2×285.5 kJ•mol-1;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,CO不是稳定氧化物;
C.氮气与氢气的反应为可逆反应,反应物不可能完全转化成生成物;
D.已知C2H4(g)和C2H5OH(l)的燃烧热分别是1411.0kJ/mol和1366.8kJ/mol,则有:①C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
②C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g)△H=-1366.8kJ/mol;
根据盖斯定律 ①-②可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以水分解的热化学方程式:H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.5 kJ•mol-1;故B错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成CO放出的热量不是燃烧热,产物应该是二氧化碳,故B错误;
C.在一定条件下将1molN2和3molH2置于一密闭容器中充分反应,该反应为可逆反应,则反应生成氨气的物质的量小于2mol,则放出的热量一定小于92.4 kJ,故C错误;
D.乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则:①C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol、②C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,
根据盖斯定律 ①-②可得:C2H4(g)+H2O(l)=C2H5OH(l)故△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,故D正确;
故选D.
点评 本题考查了反应热与焓变的应用,题目难度中等,明确燃烧热的概念、可逆反应特点为解答关键,注意熟练掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 对某一达到化学平衡状态的反应,若外界条件使反应速率改变,平衡一定会移动 | |
| C. | 在电解精炼铜的过程中,电解液中c(Cu2+)减小 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-11 |
| A. | b>a>c | B. | c>a>b | C. | c>b>a | D. | a>b>c |
| A. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| B. | 已知101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则该反应的反应热为221 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量 | |
| D. | 已知HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ•mol-1 |
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A. | 此反应的平衡常数表达式是K=$\frac{{c}^{2}(X)•c(Y)}{{c}^{3}(W)}$ | |
| B. | 达到平衡后,升高温度,W的体积分数减少,则此反应的△H>0 | |
| C. | 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动 | |
| D. | 达到平衡后,将容器体积压缩为2L,W的物质的量浓度变为0.75mol•L-1 |

| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,则金属2可能是铁 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2是铜,则生成2 mol铜时反应过程中转移2 mol电子 |
| A. | 2.1g | B. | 3.6g | C. | 7.2g | D. | 无法确定 |
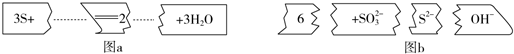
| A. | 配平后的化学计量数依次为3、1、2、6、3 | |
| B. | 若有1 mol S被氧化,则生成2 mol S2- | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 2 mol S参加反应有3 mol电子发生转移 |

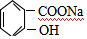 .
.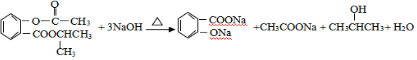 .
.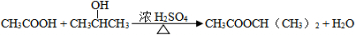 .
. .
.