题目内容
13.把图b的碎纸片补充到图a中,可得到一个完整的离子方程式.下列有关该离子方程式的说法正确的是( )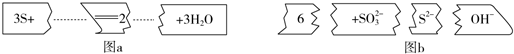
| A. | 配平后的化学计量数依次为3、1、2、6、3 | |
| B. | 若有1 mol S被氧化,则生成2 mol S2- | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 2 mol S参加反应有3 mol电子发生转移 |
分析 在碱性条件下,S与氢氧根离子反应生成硫离子、亚硫酸根离子和水,其反应的离子方程式为:3S+6OH-=2S2-+SO32-+H2O,反应中S元素的化合价从0价部分升高为+4价,部分降低为-2价,据此分析.
解答 解:A.在碱性条件下,S与氢氧根离子反应生成硫离子、亚硫酸根离子和水,其反应的离子方程式为:3S+6OH-=2S2-+SO32-+H2O,故A错误;
B.若有1 mol S被氧化,则转移4mol电子,则生成2 mol S2-,故B正确;
C.若有1 mol S被氧化,则转移4mol电子,有2molS被还原,所以氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.由方程式可知3molS参加反应转移4mol电子,则2 mol S参加反应有$\frac{8}{3}$ mol电子发生转移,故D错误.
故选B.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
5.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
6.化学与人类生活、生产、环境密切相关,下列有关说法不正确的是( )
| A. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 | |
| C. | “84”消毒液主要成分为次氯酸钠,与适量白醋混合使用消毒效果会更好 | |
| D. | 夏季马路喷洒氯化钙溶液,氯化钙跟水分子结合形成结晶水合物起到保湿作用 |
1.实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4•7H2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
(l)制备皓矾的实验流程如图所示.
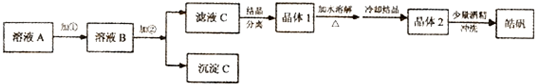
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
(l)制备皓矾的实验流程如图所示.

已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
2.水溶液X中只可能溶有Na+、Ca2+、Fe3+、AlO2-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶液迸行了如下实验:下列判断正确的是( )
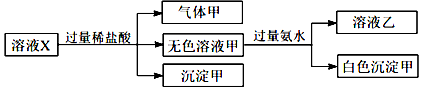

| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | Na+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
 请回答下列问题:
请回答下列问题: