题目内容
7.向0.1mol•L-1的CH3COOH溶液中加水或加入少量CH3COONa晶体时,下列有关叙述不正确的是( )| A. | 都能使溶液的pH增大 | |
| B. | 都能使溶液中c(H+)•c(CH3COO-)减小 | |
| C. | 都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大 | |
| D. | 溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变 |
分析 加水时CH3COOH?H++CH3COO-正向移动,c(H+)减小,Ka不变;
加少量CH3COONa晶体CH3COOH?H++CH3COO-逆向移动,c(H+)减小,Ka不变,以此来解答.
解答 解:A.c(H+)均减小,都能使溶液的pH增大,故A正确;
B.由Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可知,加少量CH3COONa晶体CH3COOH?H++CH3COO-逆向移动,c(CH3COOH)增大,则c(H+)•c(CH3COO-)增大,故B错误;
C.由Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可知,c(H+)均减小,则都能使溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大,故C正确;
D.Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,Ka只与温度有关,则溶液中$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变,故D正确;
故选B.
点评 本题考查弱电解质的电离平衡,为高频考点,把握平衡移动、Ka与离子浓度和温度的关系为解答的关键,侧重分析与应用能力的考查,注意Ka只与温度有关,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
12.白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
| A. | 上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 上述两个反应中,氧化产物都是H3PO4 | |
| C. | 反应(2)中,1mol CuSO4可氧化1/5molP | |
| D. | 上述两个反应中,氧化剂都只有硫酸铜 |
16.在电解质溶液均为稀硫酸的情况下,不能构成原电池的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
17.下列说法正确的是( )
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
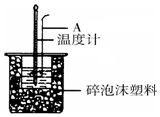 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.