题目内容
19.某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.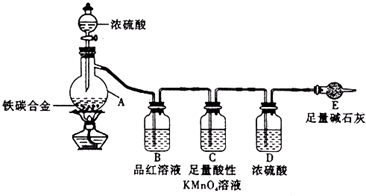
(1)称取w g铁碳合金,加入足量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;②.
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)B中的现象是:品红溶液褪色;C的作用是:除尽反应产物中的SO2气体.
(4)如果利用球形干燥管反应前后质量的变化来测定铁的质量分数,甲同学认为结果可能偏大,理由是装置内的CO2难以被E完全吸收;也可能偏小,理由是空气中的CO2和水被碱石灰吸收.
(5)乙同学认为可以用烧瓶里反应后的溶液经过一系列操作来测定铁的质量分数:加入足量的NaOH溶液、洗涤、在空气中、称重.
洗涤应该在过滤装置中进行;检查是否洗净,需要用到的试剂是BaCl2溶液.
一系列操作后所得固体为a g,则合金中铁的质量分数为$\frac{70a}{w}$%.
(6)丙同学认为可以用中和滴定的方法来测定铁的质量分数:将反应后烧瓶里的溶液转移至锥形瓶中,加入0.1000mol/L氢氧化钠溶液30.00mL,反应完全后,加2滴甲基橙溶液,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.10mL.
①把标准盐酸注入润洗过的红色手柄滴定管后,应该打开活塞,使,并使液面位于零刻度或零刻度以下位置,记录读数.
②从物质性质的角度分析,该方法即使操作规范,也有很大的误差,其实属于“方法错误”,理由是因为溶液中可能同时有+3价和+2价的铁,无法计量,不能用甲基橙,因为酸性环境,可能造成沉淀溶解.
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,如果碱石灰吸收了空气中的二氧化碳和水,则导致测量的二氧化碳的质量偏大,即合金中碳元素的质量偏大;
(5)称取w g铁碳合金,加入足量浓硫酸反应生成硫酸铁,加入足量的NaOH溶液,过滤洗涤干燥,灼烧至恒重,称量得到氧化铁的质量ag,结合元素守恒和质量分数定义计算;洗涤应该在过滤装置中进行;检查是否洗净,需要用到的试剂是氯化钡溶液检验是否含有硫酸根离子;
(6)①依据滴定管使用方法和基本操作回答;
②溶液中可能同时有+3价和+2价的铁,无法计量,甲基橙变色范围是3.1--4.4属于酸性溶液,可能溶解沉淀.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量偏大,质量分数偏大,也可能偏小是因为空气中的CO2和水被碱石灰吸收,则导致测量的二氧化碳的质量偏大,即合金中碳元素的质量偏大,铁元素的质量偏小,质量分数偏小;
故答案为:装置内的CO2难以被E完全吸收;空气中的CO2和水被碱石灰吸收;
(5)称取w g铁碳合金,加入足量浓硫酸反应生成硫酸铁,加入足量的NaOH溶液,过滤洗涤干燥,灼烧至恒重,称量得到氧化铁的质量ag,结合元素守恒和质量分数定义计算;洗涤应该在过滤装置中进行;检查是否洗净,需要用到的试剂是氯化钡溶液检验是否含有硫酸根离子;
合金中铁的质量分数=$\frac{\frac{ag}{160g/mol}×2×56g}{Wg}$×100%=$\frac{70a}{w}$%;
故答案为:BaCl2溶液;$\frac{70a}{w}$;
(6)①把标准盐酸注入润洗过的红色手柄滴定管后,应该打开活塞,尖嘴部分充满溶液并排出气泡,并使液面位于零刻度或零刻度以下位置,记录读数;
故答案为:尖嘴部分充满溶液并排出气泡;
②该方法即使操作规范,也有很大的误差,属于“方法错误”的理由是:因为溶液中可能同时有+3价和+2价的铁,无法计量;不能用甲基橙,因为酸性环境,可能造成沉淀溶解;
故答案为:因为溶液中可能同时有+3价和+2价的铁,无法计量,不能用甲基橙,因为酸性环境,可能造成沉淀溶解.
点评 本题考查了物质组成的分析判断,实验探究方法,滴定实验故分析应用,注意计算方法和基本操作的理解应用,掌握基础是关键,题目难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 在整个18列元素中,第1列的元素种类最多 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第1列元素均为金属元素 | |
| D. | 第9列元素中没有非金属元素 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同).
(3)在这12种元素的最高价氧化物对应水化物中,呈两性的氢氧化物是Al(OH)3
(4)在这12种元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,.
| A. | Fe (OH)3 | B. | FeCl2 | C. | FeS | D. | Al(OH)3 |
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液HCO3-+OH-═CO32-+H2O | |
| B. | 氯化铁溶液中通入硫化氢气体2Fe3++S2-═2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳Ca++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | FeCl3溶液中加入少量的HI溶液:2Fe3++2I-═2Fe2++I2 |
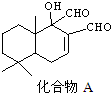
| A. | A的分子式为C15H20O3 | B. | 能发生银镜反应 | ||
| C. | 分子中有3个手性碳原子 | D. | 1molA最多与1molH2完全加成 |