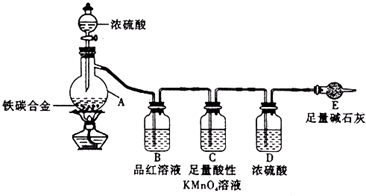
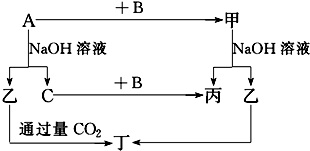
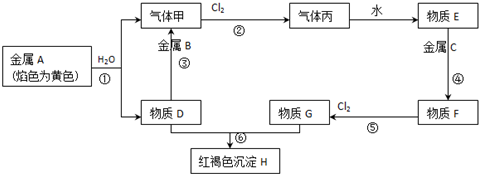
题目内容
8.(1)粗制CuSO4•5H2O晶体中常含有杂质Fe2+.①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好选用的是D.
A.氯水 B.HNO3 C.KMnO4 D.H2O2
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的AB.
A.CuO B.Cu(OH)2 C.NaOH D.NH3•H2O
(2)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10].
分析 (1)①氧化剂使Fe2+氧化为Fe3+,不能引入新杂质;
②调整溶液至pH=4,使Fe3+转化为Fe(OH)3,可加不溶于水的物质促进铁离子的水解,且不引入新杂质;
(2)由Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20可知,氢氧化铜更难溶,先生成;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$,以此来解答.
解答 解:(1)①氧化剂使Fe2+氧化为Fe3+,不能引入新杂质,只有过氧化氢符合,故答案为:D;
②调整溶液至pH=4,使Fe3+转化为Fe(OH)3,可加不溶于水的物质促进铁离子的水解,且不引入新杂质,而C、D均与金属阳离子反应,故答案为:AB;
(2)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3,故答案为:2.7×10-3.
点评 本题考查混合物分离提纯及难溶电解质的溶解平衡,为高频考点,把握物质的性质、性质差异及溶解平衡的计算等为解答的关键,侧重混合物分离提纯及分析与计算能力的考查,题目难度不大.

| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
(2)A、E两元素的氢化物中最稳定的是HF(填化学式);
(3)C元素的最高价氧化物的化学式是MgO;
(4)B的最高价氧化物的水化物和D的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |