题目内容
11.选用适当的试剂和操作,除去括号内的杂质,并写出相应的离子方程式.可供选择的试剂有:A足量CO2 B.澄清石灰水 C.饱和 NaHCO3溶液 D.CaCl2溶液 E.水 F.Cu G.Fe
操作有:(1)过滤 (2)分液 (3)洗气瓶洗气 (4)无 (试剂和操作用字母及序号回答)试剂和操作 离子方程式:
(1)SiO2(CaO):E、(1)、CaO+H2O=Ca2++2OH-
(2)CO2(HCl):C、(3)、HCO3-+H+=CO2+H2O
(3)FeCl2溶液(CuCl2):G、(1)、Cu2++Fe=Cu+Fe2+
(4)NaHCO3溶液(Na2CO3):A、(4)、CO32-+CO2+H2O=2HCO3-.
分析 (1)CaO与水反应后溶于水,而二氧化硅不溶于水;
(2)饱和碳酸氢钠溶液与HCl反应生成二氧化碳;
(3)Fe与氯化铜反应生成氯化亚铁和Cu;
(4)碳酸钠、水、二氧化碳反应生成碳酸氢钠.
解答 解:(1)CaO与水反应后溶于水,而二氧化硅不溶于水,则选择试剂为E,分离方法为(1),发生的离子反应为CaO+H2O=Ca2++2OH-,
故答案为:E、(1)、CaO+H2O=Ca2++2OH-;
(2)饱和碳酸氢钠溶液与HCl反应生成二氧化碳,则选择试剂为C,分离方法为(3),发生的离子反应为HCO3-+H+=CO2+H2O,
故答案为:C、(3)、HCO3-+H+=CO2+H2O;
(3)Fe与氯化铜反应生成氯化亚铁和Cu,则选择试剂为G,分离方法为(1),发生的离子反应为Cu2++Fe=Cu+Fe2+,
故答案为:G、(1)、Cu2++Fe=Cu+Fe2+;
(4)碳酸钠、水、二氧化碳反应生成碳酸氢钠,则选择试剂为A,分离方法为(4),发生的离子反应为CO32-+CO2+H2O=2HCO3-,
故答案为:A、(4)、CO32-+CO2+H2O=2HCO3-.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应等为解答的关键,侧重混合物分离提纯及分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
1.下列化学用语表示正确的是( )
| A. | 水的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: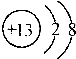 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
2.下列有关化学用语或表达正确的是( )
| A. | 三硝酸纤维素脂 | B. | 硬酯酸钠 | ||
| C. | 硝酸苯的结构简式: | D. | NaCl晶体模型: |
3.下列化学方程式或离子方程式正确的是( )
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
1.下列物质的贮存方法不正确的是( )
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |