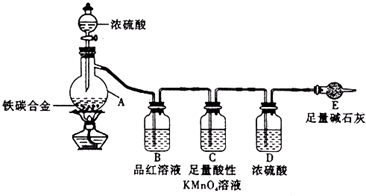
题目内容
4.若把长式元素周期原先的主副族及族号取消,由左至右改为18列.如碱金属元素为第1列,稀有气体元素为第18列,按此规定下列说法正确的是( )| A. | 在整个18列元素中,第1列的元素种类最多 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第1列元素均为金属元素 | |
| D. | 第9列元素中没有非金属元素 |
分析 长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA→ⅦA、0族,18列元素应分别与以上各族对应,所以第2列为碱土金属族,其最外层有2个电子,但元素He及多数过渡元素的最外层也是2个电子;第3列为ⅢB族,有镧系和锕系元素,元素种类最多;第14列为碳族元素,形成化合物的种类最多(有机物);第10列为过渡区元素,全部为金属;第18列为稀有气体元素.
解答 解:A、第3列为ⅢB族,有镧系和锕系元素,元素种类最多,故A错误;
B、所以第2列为碱土金属族,其最外层有2个电子,但元素He及多数过渡元素的最外层也是2个电子,故B错误;
C、第1列氢为非金属元素,故C错误;
D、第9列为Ⅷ族元素,没有非金属元素,全部是金属,故D正确;
故选D.
点评 本题主要考查了长式周期表中各族元素的排列顺序,只要掌握了排列顺序,结合所学基础知识即可完成,难度不大.

练习册系列答案
相关题目
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下11.2L的水中含有0.5个NA水分子 | |
| B. | 0.1mol•L-1 NaCl溶液中Na+的数目为0.1NA | |
| C. | 1mol H2和O2的混合气体中含NA个分子 | |
| D. | 在常温常压下,18克水含有的原子数为3NA |
15.下列有关说法正确的是( )
| A. | 相同温度下,0.1 mol•L-1NH4Cl溶液比0.1 mol•L-1NH4HSO4溶液含有的[NH4+]更大 | |
| B. | 将0.1 mol•L-1硫酸溶液从常温加热至100℃,溶液的pH保持不变 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| D. | 在蒸发皿中加热蒸发(低于400℃)FeCl3溶液,可以得到FeCl3固体 |
12.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 酸钡难溶于水和酸,可做X光透视肠胃的药剂 |
19.下列有关同位素叙述正确的是( )
| A. | ${\;}_{6}^{12}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$及金刚石、石墨都是碳的同位素 | |
| B. | 同位素的原子的物理性质、化学性质相同 | |
| C. | 同位素原子的本质区别在于质量数不同 | |
| D. | 质子数相同,中子数不同的原子互为同位素 |
9.下列有关元素性质的递变规律正确的是( )
| A. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HCl、H2S、PH3的稳定性逐渐减弱 | |
| C. | 第3周期自左往右原子和离子半径均依次减小 | |
| D. | 向MgCl2溶液中加入金属钠发生2Na+MgC12═2NaC1+Mg,所以金属性Na>Mg |
1.下列化学用语表示正确的是( )
| A. | 水的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: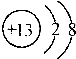 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |