题目内容
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是 (填编号).
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是 .
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 .
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是 (填字母),其中化合价为+3价的是 (填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是 .

请回答下列问题:
(1)表中属于d区的元素是
(2)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素;
(2)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,C元素电负性不大,分子中不存在氢键,为对称结构,属于非极性分子,分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,根据杂化轨道数目确定杂化方式,据此结合选项解答;
(3)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,为N原子,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键;
(4)金属元素的第一电离能比较小,第一个电子易失去,通过表格可以看出第一电离能比较小属于金属元素;前三电离能比较小,第四电离能突然增大,此元素的化合价为+3价;同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,第一电离能比较大,为特殊情况.
(2)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,C元素电负性不大,分子中不存在氢键,为对称结构,属于非极性分子,分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,根据杂化轨道数目确定杂化方式,据此结合选项解答;
(3)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,为N原子,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键;
(4)金属元素的第一电离能比较小,第一个电子易失去,通过表格可以看出第一电离能比较小属于金属元素;前三电离能比较小,第四电离能突然增大,此元素的化合价为+3价;同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若某元素np轨道上的电子半满,不易失去一个电子,第一电离能比较大,为特殊情况.
解答:
解:(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素,由元素在周期表中的位置可知,⑨处于第10列,为第Ⅷ族,属于d区元素,故答案为:⑨;
(2)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.C元素电负性不大,分子中不存在氢键,故A错误
B.乙烯为对称结构,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子呈1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(3)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,该原子外层电子的孤对电子数
为1,为N元素,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键,故NH3在H2O中的溶解度很大,
故答案为:1,三角锥型;NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键;
(4)金属元素的第一电离能比较小,第一个电子容易失去,通过表格可以看出DEF的第一电离能比较小;化合价为+3价,说明前三电离能比较小,第四电离能突然增大,故符合的只有F;
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为(1)DEF;F;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大.
(2)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.C元素电负性不大,分子中不存在氢键,故A错误
B.乙烯为对称结构,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子呈1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(3)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,该原子外层电子的孤对电子数
为1,为N元素,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键,故NH3在H2O中的溶解度很大,
故答案为:1,三角锥型;NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键;
(4)金属元素的第一电离能比较小,第一个电子容易失去,通过表格可以看出DEF的第一电离能比较小;化合价为+3价,说明前三电离能比较小,第四电离能突然增大,故符合的只有F;
若A、B、C依次为同周期相邻元素,第一电离能一般为非金属性越强,第一电离能越大,若B的np轨道上的电子半满,能量比A和C低,不易失去一个电子,故第一电离能比A和C大;
故答案为(1)DEF;F;B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大.
点评:本题考查元素周期表的结构、晶胞计算、分子结构与性质、电离能等,难度中等,注意(4)中电离能与化合价的关系.

练习册系列答案
相关题目
近期,北京,珠三角近相继出现了PM2.5大范围超标的情况.科学家用PM2.5表示每立方米空气中这种颗粒的含量,这个值越高,就代表空气污染越严重,对人身体的健康危害越大.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,汽车尾气、冬天供暖锅炉烟气排放、工厂的烟气排放、低温无风天气的持续导致PM2.5持续走高.下列有关说法中正确的是:( )
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
| A、(1)(2)(3)(7) |
| B、(2)(3)(5)(7) |
| C、(2)(5)(6) |
| D、(2)(3)(4)(5)(7) |
符合如图中阴影部分的物质是( )


| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、NaCl |
| D、NaHSO4 |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)═2Z(g),经60s达到平衡,生成0.4molZ.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
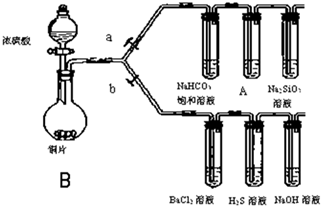 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
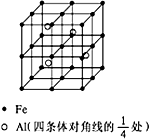 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物. (1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)
(1)选择下列物质:①MgCl2②金刚石③NH4Cl④KNO3⑤干冰⑥单质碘晶体,按要求填空.(填序号)