题目内容
17.近年来对CO2的有效控制及其高效利用德尔研究正引起全球广泛关注.据中国化工报报道,用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯度CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ/mol
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ/mol
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示).
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图1(反应①已标明).结合各反应的△H,归纳lgK~T曲线变化规律
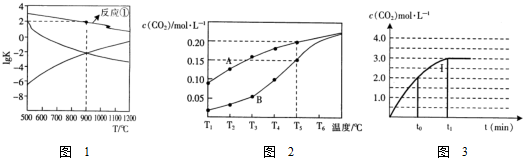
(a)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;
(b)当温度同等变化时,△H的数值越大lgK的变化越大.
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900°C达到平衡,c(CO)平衡=8.0×10-2mol•L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)99%.为减少副产物②,下列措施中可行的是AC.(填编号).
A.控制适当温度,体系温度不宜过高 B.增大体系压强 C.在初始燃料中加入适量CO2 D.减少CaSO4的用量
(4)一定条件下,在体积为2L的真空密闭容器中加入1molCaSO4和1molCO,假设只发生反应②,测得二氧化碳的物质的量浓度随温度的变化关系如图2所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.
则:温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的反应速率v(CO2)为0.005mol/(L•s).请说明随温度的升高,曲线B向曲线A逼近的原因:随着温度升高,反应速率加快,达到平衡所需要的时间变短.
(5)某温度下,2L的密闭容器中只发生反应①,已知某组实验c(CO2)与反应时间t变化曲线.若在t0时刻将容器的体积扩大至4L,请在图中绘出c(CO2)与反应时间t变化曲线.
分析 (1)根据盖斯定律及题干中热化学方程式计算出反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H;
(2)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律;
(3)根据图象判断900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为c,根据平衡常数表达式列式计算即可;反应②是吸热反应温度升高平衡正向进行,减少副反应进行需要平衡逆向进行;
(4)由图可知,温度越高,二氧化碳的物质的量浓度越大,说明此反应为吸热反应,T5℃时二氧化碳的物质的量浓度为0.2mol/L,据此计算反应速率即可;温度对反应速率的影响判断:温度越高,反应速率越大,反之,温度越低;
(5)已知某组实验c(CO)与反应时间t变化曲线Ⅰ(如图),若在t0时刻将容器的体积扩大至4L,各组分的浓度都减小,反应速率减小,达平衡所需时间变长;
解答 解:(1)根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=4△H1+△H2+2△H3,
故答案为:4△H1+△H2+2△H3;
(2)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,
故答案为:(a)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;(b)当温度同等变化时,△H的数值越大lgK的变化越大;
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应方程式为:$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ•mol-1,根据图象曲线可知,反应①于900℃时lgK=2,平衡常数为102=100,c平衡(CO)=8.0×10-5 mol•L-1,设一氧化碳反应前浓度为c,则反应消耗的CO浓度=反应生成二氧化碳浓度=(c-8.0×10-5)mol/L,平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{c-8.0×1{0}^{-5}}{8×1{0}^{-5}}$=100,解得c=8.08×10-3mol/L,一氧化碳的转化率为:$\frac{8.0×1{0}^{-3}}{8.08×1{0}^{-3}}$×100%≈99%,
反应②是吸热反应温度升高平衡正向进行,减少副反应进行需要平衡逆向进行,
A.温度升高平衡正向进行,副反应正向进行,控制适当温度,体系温度不宜过高,故A正确;
B.增大体系压强副反应③正向进行,故B错误;
C.在初始燃料中加入适量CO2 抑制副反应正向进行,故C正确;
D.固体不影响化学平衡,减少CaSO4的用量不能减少副反应的发生,故D错误;故选AC,
故答案为:99%;AC;
(4)①温度越高,二氧化碳的物质的量浓度越大,此反应为吸热反应,T5℃时二氧化碳的物质的量浓度为0.2mol/L,v(CO2)=$\frac{△c(C{O}_{2})}{△t}$=0.005mol/(L•s),根据温度对反应速率的影响可知,随着温度升高,反应速率加快,达到平衡所需要的时间变短,所以曲线B向曲线A逼近,
故答案为:0.005mol/(L•s);随着温度升高,反应速率加快,达到平衡所需要的时间变短;
(5)已知某组实验c(CO)与反应时间t变化曲线Ⅰ(如图一).若在t0时刻将容器的体积扩大至4L,各组分的浓度都减小,反应速率减小,达平衡所需时间变长,纵坐标起点1.0,终点1.5,横坐标起点t0,终点>t1,图象为 ,
,
故答案为: .
.
点评 本题考查了化学平衡常数的计算、影响平衡移动的因素、化学平衡常数的计算、电离平衡常数的应用、热化学方程式的书写等知识,题目中等难度,答题时注意学会从图中获取信息,并注意对平衡常数概念的理解,明确热化学方程式的书写方法及盖斯定律的含义及应用.

| A. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气与11.2LNH3含有的原子数相同 | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?CO Cl2(g)△H=-108kJ/mol,反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.2 | 0.6 |
| 1 | 0.9 | |
| 2 | 0.2 | |
| 4 | 0.8 |
②在2~4min间v(Cl2)正=v(Cl2)逆(填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2(g)?CO Cl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数
B.使用合适的催化剂可以增大反应体系中COCl2(g)的体积分数
C.若改变某个反应条件,反应体系中COCl2(g)的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K 值不变时,说明反应已经达到平衡
(3)用CO与H2在高温下合成C5H12(汽油的一种成分).己知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(l)表示L一定时,CO的转化率随X的变化关系,则X代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.

(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1molCH4,理论上需要消耗CO的物质的量为4mol.
| A. | 在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 | |
| B. | 在ZnSO4溶液中各离子的浓度关系为:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等体积的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常温下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8 |