题目内容
2.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)?CH3OH(g),如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
(1)T1和T2温度下的平衡常数大小关系是K1>K2(填“>”、“<”或“=”).
(2)由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,则曲线c所表示的温度为350℃.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是1.3×104 kPa 下CO 的转化率已经很高,如果增大压强,CO 的转化率提高不大,而生产成本增加很多,得不偿失.
(3)以下有关该反应的说法正确的是AD(填序号).
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2molCO和6molH2充入2L固定容积的密闭容器中,充分反应,达到平衡后测得c(CO)=0.2mol•L-1,则CO的转化率为80%
(4)一定温度下,向2L的固定体积的密闭容器中加入1molCH3OH(g),发生反应:CH3OH(g)?CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图3所示.
该温度下,反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K=4L2•mol-2.相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则C(填序号)是原来的2倍.
A.CH3OH的平衡浓度 B.达到平衡的时间 C.平衡时气体的密度.
分析 (1)图1分析先拐先平温度高,T2<T1,结合平衡移动原理分析判断平衡移动方向确定平衡常数大小;
(2)图1分析可知,温度越高一氧化碳转化率越小,说明正反应为放热反应,根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答,从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动;
(3)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,注意该该反应中反应物的化学计量数之和与生成物的化学计量数关系;
(4)据图象可求出H2的化学反应速率,再据化学反应中用各物质表示的速率之比等于系数之比,可求得第一问.据三段式法求得平衡时各物质的浓度,
CH3OH(g)?CO(g)+2H2(g)
反应前浓度(mol/L )0.5 0 0
反应的浓度(mol/L )0.25 0.25 0.5
反应的浓度(mol/L )0.25 0.25 0.5
代入平衡常数表达式计算,气体体积不变,质量增倍,密度增倍;
解答 解:(1)图1分析先拐先平温度高,T2<T1,温度越高,一氧化碳转化率越小,平衡常数越小,则T1和T2温度下的平衡常数大小关系是K1>K2,
故答案为:>;
(2)图1分析可知,温度越高一氧化碳转化率越小,说明正反应为放热反应,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如图2所示,温度最高的是c曲线为350°,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:350,1.3×104 kPa 下CO 的转化率已经很高,如果增大压强,CO 的转化率提高不大,而生产成本增加很多,得不偿失;
(3)CO(g)+2H2(g)?CH3OH(g),反应是气体体积减小的放热反应,
A.反应前后气体物质的量变化,恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡,故A正确;
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,只能说明反应正向进行,不能说明可逆反应达到平衡,故B错误;
C.使用合适的催化剂能缩短达到平衡的时间,但不改变化学平衡,不能提高CH3OH的产率,故C错误;
D.某温度下,将2molCO和6molH2充入2L固定容积的密闭容器中,充分反应,达到平衡后测得c(CO)=0.2mol•L-1,则CO的转化率=$\frac{2mol-2L×0.2mol/L}{2mol}$×100%=80%,故D正确;
故答案为:AD;
(4)据图象可求出H2的化学反应速率,再据化学反应中用各物质表示的速率之比等于系数之比,可求得第一问.据三段式法求得平衡时各物质的浓度,
CH3OH(g)?CO(g)+2H2(g)
反应前浓度(mol/L )0.5 0 0
反应的浓度(mol/L )0.25 0.25 0.5
反应的浓度(mol/L )0.25 0.25 0.5
代入公式K=$\frac{0.5×0.5×0.25}{0.25}$=0.25,求得该反应的化学平衡常数为0.25(mol•L)2.所求反应的K,是该反应的逆反应,所以系数是其倒数则平衡常数=$\frac{1}{0.25}$L2•mol-2=4L2•mol-2.
体积不变的容器中,反应物与生成物全是气体,质量加倍,故密度加倍,选C,
故答案为:4L2•mol-2,C;
点评 本题考查化学反应中能量变化,化学反应速率、化学平衡影响因素与化学平衡图象、平衡常数计算等,注意根据反应的特征分析图象中条件的改变,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 长度 | B. | 质量 | C. | 数量 | D. | 物质的量 |
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
| A. | 实验室用大理石和稀盐酸反应制CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
| A. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| B. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 | |
| C. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| D. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |

| A. | 用甲图装置电解精炼镁 | |
| B. | 用乙图装置验证试管中铁丝发生析氢腐蚀 | |
| C. | 用丙图装置构成铜锌原电池 | |
| D. | 用丁图装置对充电电池进行充电 |
| A. | 该反应的离子方程式为CO32-+2H+═CO2↑+H2O | |
| B. | 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大 | |
| C. | CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
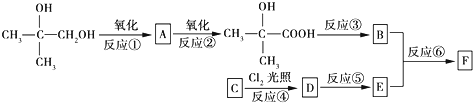
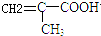 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$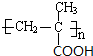 .
.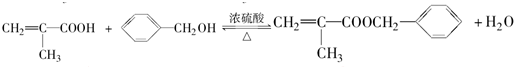 .
. .
.