题目内容
19.用电子式表示:①过氧化钠 ;②二氧化碳
;②二氧化碳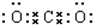 .③氯化镁的形成过程:
.③氯化镁的形成过程: ;④次氯酸的形成过程:
;④次氯酸的形成过程: .
.
分析 ①过氧化钠为离子化合物,化合物中存在钠离子和过氧根离子,两个氧原子之间共用1对电子;
②二氧化碳为共价化合物,分子中存在两个碳氧双键;
③氯化镁为离子化合物,由离子形成离子键;
④次氯酸为共价化合物,分子中存在H-O,和O-Cl共价键.
解答 解:①过氧化钠为离子化合物,化合物中存在钠离子和过氧根离子,两个氧原子之间共用1对电子,过氧化钠的电子式为: ,
,
故答案为: ;
;
②二氧化碳为共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为: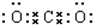 ;
;
故答案为: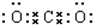 ;
;
③氯化镁为离子化合物,由离子形成离子键,其形成过程为 ,
,
故答案为: ;
;
④次氯酸为共价化合物,分子中存在H-O,和O-Cl共价键,用电子式表示的形成过程为 ;
;
故答案为: .
.
点评 本题考查化学用语,涉及物质的电子式,用电子式表示物质形成过程,题目难度中等,熟练掌握电子式的概念及表示方法是解题关键,有助于培养学生化学用语的规范性.

练习册系列答案
相关题目
7.根据如图,下列判断中正确的是( )
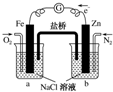

| A. | 烧杯a中的溶液pH降低 | B. | 烧杯b中发生的反应为2H++2e-═H2↑ | ||
| C. | 烧杯a中发生的反应为Fe-2e-═Fe2+ | D. | 烧杯b中发生氧化反应 |
14.由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是( )
| 选项 | 反应类型 | 反应条件 |
| A | 加成反应、取代反应、消去反应 | NaOH醇溶液/加热、NaOH水溶液/加热、常温 |
| B | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| C | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
| D | 氧化反应、取代反应、消去反应 | 加热、NaOH醇溶液/加热、NaOH水溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
4.在密闭容器中进行X2(g)+2Y2(g)?Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.9mol/L |
2.下列说法正确的是( )
| A. | 接触法制备硫酸主要的设备有沸腾炉、合成塔和吸收塔 | |
| B. | 工业制备硫酸中,尾气二氧化硫使用NaOH溶液吸收的 | |
| C. | 工业制备硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 | |
| D. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出热量 |

 化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.
化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.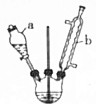 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: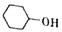 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O