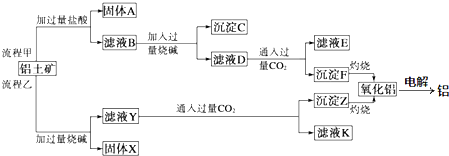
题目内容
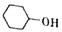
20. 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:3
 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
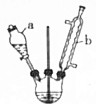
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O反应装置(部分夹持装置和加热装置已省略)如图所示.
实验步骤:
步骤1:在三颈瓶中加入16.0mL50%硝酸(ρ=1.31g•cm-3)和微量(0.01g)偏钒酸铵,三颈瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b.用仪器a滴加5.3mL环己醇,仪器b另一端连接气体吸收装置,用烧碱作吸收溶液.
步骤2:首先将三颈瓶内液体加热到50℃左右,开动搅拌器,滴入环己醇(ρ=0.9624g•cm-3),使反应处于微沸状态.滴加完毕后于90℃左右水浴加热20分钟,至反应完毕.
步骤3:趁热倒出三颈瓶中的混合液于烧杯内,将烧杯静置于冰水浴中冷却析出产品,过滤,用少量冷水洗涤,干燥后称重.
步骤4:将粗产品在水中进行重结晶操作,最终得到5.6g产品.
请回答下列问题:
(1)使用仪器b的目的是起冷凝、回流作用;向三颈瓶中加入环己醇的操作是先打开分液漏斗上口的塞子,再打开活塞,缓慢滴入环己醇.
(2)如果向三颈瓶种快速一次性加入环己醇,产率会减小(填“增大”、“减小”或“不变”,下同);本实验若用发烟硝酸替代50%硝酸,产率会减小.
(3)下列有关加入偏钒酸铵的说法合理的是C.
A.避免副产品生成 B.提高产品的产率
C.提高合成产品的速率 D.防加热时溶液暴沸
(4)步骤3中用“冷水”洗涤,不用热水洗涤,其目的是己二酸随着温度的降低溶解度减小,用“冷水”洗涤己二酸减少溶解,热水洗涤己二酸会溶解.
(5)烧碱溶液吸收空气的尾气,最终只生成一种最高价态盐.写出该反应的离子方程式:4NO+3O2+4OH-=4NO3-+2H2O.
(6)该实验的产率约为73.2%.
分析 (1)仪器b的名称为:球形冷凝管,起冷凝、回流作用;通过分液漏斗加入液体时,首先打开分液漏斗上口的塞子,保证内外压强一致;
(2)向三颈瓶种快速一次性加入环己醇,环己醇挥发;发烟硝酸易分解,反应物减少;
(3)在此反应过程中利用了硝酸的强氧化性氧化环己醇得到己二酸,故偏钒酸铵的作用是催化剂;
(4)从题目中信息可知己二酸随着温度的降低溶解度减小;
(5)尾气的成分为一氧化氮和氧气,与烧碱反应生成硝酸钠;
(6)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)仪器b的名称为:球形冷凝管,冷水从冷凝管下口入,上口出,起冷凝、回流作用;向三颈瓶中加入环己醇的操作是先打开分液漏斗上口的塞子,再打开活塞,缓慢滴入环己醇;
故答案为:起冷凝、回流作用;先打开分液漏斗上口的塞子,再打开活塞,缓慢滴入环己醇;
(2)向三颈瓶种快速一次性加入环己醇,环己醇挥发,产率会减小;本实验若用发烟硝酸替代50%硝酸,发烟硝酸易分解,反应物减少,产率会减小;
故答案为:减小;减小;
(3)在此反应过程中利用了硝酸的强氧化性氧化环己醇得到己二酸,故偏钒酸铵的作用是催化剂,提高合成产品的速率;
故选C.
(4)己二酸随着温度的降低溶解度减小,故用“冷水”洗涤己二酸减少溶解;
故答案为:己二酸随着温度的降低溶解度减小,用“冷水”洗涤己二酸减少溶解,热水洗涤己二酸会溶解;
(5)尾气的成分为一氧化氮和氧气,与烧碱反应生成硝酸钠,方程式为:4NO+3O2+4NaOH=4NaNO3 +2H2O,离子方程式:4NO+3O2+4OH-=4NO3-+2H2O;
故答案为:4NO+3O2+4OH-=4NO3-+2H2O;
(6)16.0mL 50% 硝酸(ρ=1.31g•cm-3)的物质的量为$\frac{16.0mL×1.31g•c{m}^{-3}×50%}{63g/mol}$=0.166mol,5.3mL环己醇的物质的量为$\frac{5.3mL×0.9624g•c{m}^{-3}}{100g/mol}$=0.051mol,由根据方程式3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O可知环己醇不足,生成的HOOC(CH3)4COOH的物质的量为0.051mol,质量为0.051mol×150g/mol=7.65g,所以己二酸的产率为$\frac{5.6g}{7.65g}$×100%=73.2%;
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O可知环己醇不足,生成的HOOC(CH3)4COOH的物质的量为0.051mol,质量为0.051mol×150g/mol=7.65g,所以己二酸的产率为$\frac{5.6g}{7.65g}$×100%=73.2%;
故答案为:73.2%;
点评 本题考查了化学基本仪器的使用,化学实验基本操作方法,产率的计算以及利用方程式的有关计算等,题目难度中等.

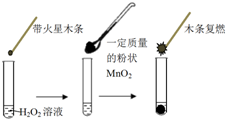 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验不能(填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
| A. | HCl | B. | NH3 | C. | CH4 | D. | CO2 |
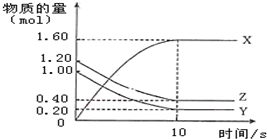 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
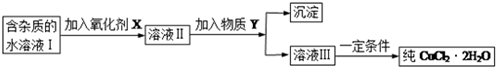
(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=4.0×10-8mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在HCl气氛中蒸发结晶.
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
 ;②二氧化碳
;②二氧化碳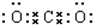 .③氯化镁的形成过程:
.③氯化镁的形成过程: ;④次氯酸的形成过程:
;④次氯酸的形成过程: .
.