题目内容
VmL Al2(SO4)3溶液中含A13+ag,取
mL该溶液稀释到5VmL,则稀释后溶液中SO42-的物质的量浓度是( )
| V |
| 5 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算出铝离子的物质的量,再根据硫酸铝的化学式组成计算出硫酸根离子的物质的量,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中 硫酸根离子的浓度.
| m |
| M |
解答:
解:ag铝离子的物质的量为:n(A13+)=
=
mol,
根据Al2(SO4)3可知,VmL该硫酸铝溶液中含有硫酸根离子的物质的量为:
mol×
=
mol,
原溶液中硫酸根离子浓度为:V(SO42)=
=
mol/L,
取
mL该溶液稀释到5VmL,则稀释后溶液中SO42-的物质的量浓度为:
mol/L×
=
mol/L,
故选A.
| ag |
| 27g/mol |
| a |
| 27 |
根据Al2(SO4)3可知,VmL该硫酸铝溶液中含有硫酸根离子的物质的量为:
| a |
| 27 |
| 3 |
| 2 |
| a |
| 18 |
原溶液中硫酸根离子浓度为:V(SO42)=
| ||
| 0.001VL |
| 500a |
| 9V |
取
| V |
| 5 |
| 500a |
| 9V |
| ||
| 5VmL |
| 20a |
| 9V |
故选A.
点评:本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及表达式,明确硫酸铝中铝离子、硫酸根离子之间关系为解答关键,试题有利于培养学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将如图所示实验装置的K闭合,下列判断正确的是( )
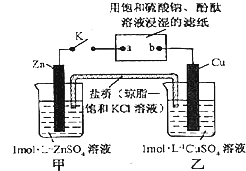

| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
| A、C12 |
| B、NH3 |
| C、CO2 |
| D、NO2 |
将0.2mol MnO2和50mL 12mol?L-1盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发)( )
| A、等于0.3 mol |
| B、小于0.3 mol |
| C、大于0.3 mol,小于0.6 mol |
| D、以上结论都不正确 |
下列关于氧化还原反应的叙述中,正确的是( )
| A、氧化还原反应的实质是元素化合价发生了变化 |
| B、氧化剂被还原,还原剂被氧化;氧化剂具有氧化性,还原剂具有还原性 |
| C、得到电子的物质被氧化,失去电子的物质被还原 |
| D、氧化还原反应中,氧化剂和还原剂一定是两种物质 |
在 xR2++y H++O2=4R3++n H2O的离子方程式中,下列判断正确的是( )
| A、y=4,R2+是氧化剂 |
| B、y=2,R2+是还原剂 |
| C、y=2,R3+是还原产物 |
| D、y=4,R3+是氧化产物 |