题目内容
将如图所示实验装置的K闭合,下列判断正确的是( )
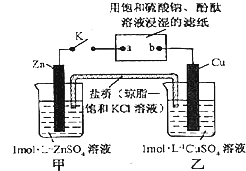

| A、片刻后可观察到滤纸b点变红色 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后甲池中c(SO42-)增大 |
| D、Cu电极上发生还原反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动.
解答:
解:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钾溶液的滤纸是电解池,a是阴极,b是阳极,
A、电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故A错误;
B、电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故B错误;
C、锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C错误;
D、铜电极上铜离子得电子发生还原反应而生成铜,故D正确;
故选D.
A、电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故A错误;
B、电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故B错误;
C、锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C错误;
D、铜电极上铜离子得电子发生还原反应而生成铜,故D正确;
故选D.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
某温度下,H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、NaOH |
| C、K2SO4 |
| D、MgSO4 |
下列说法正确的是( )
| A、金属阳离子被还原一定生成金属单质 |
| B、氧化还原反应中有一种元素被氧化,同时一定有另一种元素被还原 |
| C、有单质参加和生成的反应一定是氧化还原反应 |
| D、含有最高化合价的元素的化合物不一定有强氧化性 |
VmL Al2(SO4)3溶液中含A13+ag,取
mL该溶液稀释到5VmL,则稀释后溶液中SO42-的物质的量浓度是( )
| V |
| 5 |
A、
| ||
B、
| ||
C、
| ||
D、
|
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、CaCl2溶液 |
| B、CuSO4溶液 |
| C、Fe(OH)3胶体 |
| D、稀H2SO4 |
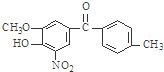 ,该有机物中含氧官能团有:
,该有机物中含氧官能团有: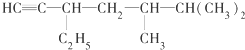 的系统名称是
的系统名称是
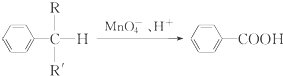 (R、R′表示烷基或氢原子)
(R、R′表示烷基或氢原子)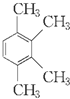 、
、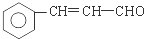 在强氧化剂条件下生成
在强氧化剂条件下生成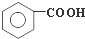 和另一种有机物
和另一种有机物 把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是