题目内容
 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产.
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产.Ⅰ.某兴趣小组对草酸亚铁的分解产物进行实验和探究.
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉.
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成.由此说明气体产物中含有
(2)将样品草酸亚铁晶体(FeC2O4?2H2O)在氩气气氛中进行热重分析,结果如图(TG表示残留固体质量占原样品总质量的百分数).
①试确定B点对应固体物质的化学式
②写出B→C对应的化学方程式
Ⅱ.某草酸亚铁样品(不含结晶水)中含有少量草酸.现用滴定法测定该样品中FeC2O4的含量.
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点.
②向滴定终点混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5~8min.用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00mL.
试回答下列问题:
(1)高锰酸钾标准液用
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为
(3)在步骤②中,下列操作会引起测定结果偏高的是
A、滴定管在盛装高锰酸钾前未润洗
B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C、滴定前读数正确,滴定终点时俯视读数
D、滴定前读数正确,滴定终点时仰视读数
(4)0.20g样品中FeC2O4的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、(1)CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成,说明反应生成的气体中含有一氧化碳和二氧化碳;
(2)①B点残留固体质量占原样品总质量的百分数位80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水;
②由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO,B点到C点是FeC2O4分解的反应;
Ⅱ、(1)高锰酸钾溶液具有强氧化性,需要盛放在酸式滴定管中;
(2)步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,是你高锰酸钾溶液氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式;
(3)滴定实验过程中误差分析利用c(待测液)=
分析判断,过程中消耗标准液的体积变化和误差关系;
(4)依据滴定过程中的数据和离子方程式的定量关系计算得到.
(2)①B点残留固体质量占原样品总质量的百分数位80%,损失20%,FeC2O4.2H2O中结晶水的质量为
| 36 |
| 180 |
②由图可知加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,即铁原子与氧原子物质的量之比为1:1,应为FeO,B点到C点是FeC2O4分解的反应;
Ⅱ、(1)高锰酸钾溶液具有强氧化性,需要盛放在酸式滴定管中;
(2)步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,是你高锰酸钾溶液氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式;
(3)滴定实验过程中误差分析利用c(待测液)=
| c(标准液)V(标准液) |
| V(待测液) |
(4)依据滴定过程中的数据和离子方程式的定量关系计算得到.
解答:
解:(1)将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,说明生成二氧化碳气体,B中有黑色物质生成,CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,说明反应生成的气体中含有一氧化碳和二氧化碳;
故答案为:CO、CO2;
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
×100%=20%,故A→B发生反应是FeC2O4.2H2O加热失去结晶水,反应方程式为:FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g),B点对应固体物质的化学式为FeC2O4 ;
故答案为:FeC2O4;
②由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,依据氧化还原反应电子守恒分析计算,碳元素化合价从+3价变化为+2价和+3价,生成一氧化碳和二氧化碳气体,原子守恒配平写出化学方程式;FeC2O4
FeO+CO↑+CO2↑;
故答案为:FeC2O4
FeO+CO↑+CO2↑;
Ⅱ、(1)高锰酸钾溶液具有强氧化性,需要盛放在酸式滴定管中;
故答案为:酸式;
(2)滴加高锰酸钾溶液时观察到有无色气体产生,是你高锰酸钾溶液氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写得到离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(3)滴定实验过程中误差分析利用c(待测液)=
分析判断;
A、滴定管在盛装高锰酸钾前未润洗,稀释高锰酸钾浓度变小,消耗标准溶液体积增大,测定结果偏高,故A符合;
B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出,待测液损耗,消耗标准溶液体积减小,测定结果偏低,故B不符合;
C、滴定前读数正确,滴定终点时俯视读数,读出的标准溶液体积减少,测定结果偏低,故C不符合;
D、滴定前读数正确,滴定终点时仰视读数,读出的标准溶液体积增大,测定结果偏高,估D符合;
故答案为:A D;
(4)分析实验过程可知,亚铁离子被高锰酸钾滴定消耗溶液体积为6.00ml,反应为;MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,依据反应的定量关系计算为:
5Fe2+~MnO4-,
5 1
n 0.02000mol/L×0.0060L
n=0.0006mol
0.20g样品中FeC2O4的质量分数=
×100%=43.2%;
故答案为:43.2%;
故答案为:CO、CO2;
(2)①由图可知,加热生成B时剩余固体为80%,损失20%,FeC2O4.2H2O中结晶水的质量为
| 36 |
| 180 |
| ||
故答案为:FeC2O4;
②由图可知B加热生成C时,分解完全,假定草酸亚铁晶体为180g,其物质的量为1mol,则C固体的质量为180g×40%=72g,铁元素质量为1mol×56g/mol=56,故应含有氧元素为72g-56g=16g,氧原子物质的量为1mol,即铁原子与氧原子物质的量之比为1:1,应为FeO,依据氧化还原反应电子守恒分析计算,碳元素化合价从+3价变化为+2价和+3价,生成一氧化碳和二氧化碳气体,原子守恒配平写出化学方程式;FeC2O4
| ||
故答案为:FeC2O4
| ||
Ⅱ、(1)高锰酸钾溶液具有强氧化性,需要盛放在酸式滴定管中;
故答案为:酸式;
(2)滴加高锰酸钾溶液时观察到有无色气体产生,是你高锰酸钾溶液氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写得到离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(3)滴定实验过程中误差分析利用c(待测液)=
| c(标准液)V(标准液) |
| V(待测液) |
A、滴定管在盛装高锰酸钾前未润洗,稀释高锰酸钾浓度变小,消耗标准溶液体积增大,测定结果偏高,故A符合;
B、滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出,待测液损耗,消耗标准溶液体积减小,测定结果偏低,故B不符合;
C、滴定前读数正确,滴定终点时俯视读数,读出的标准溶液体积减少,测定结果偏低,故C不符合;
D、滴定前读数正确,滴定终点时仰视读数,读出的标准溶液体积增大,测定结果偏高,估D符合;
故答案为:A D;
(4)分析实验过程可知,亚铁离子被高锰酸钾滴定消耗溶液体积为6.00ml,反应为;MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,依据反应的定量关系计算为:
5Fe2+~MnO4-,
5 1
n 0.02000mol/L×0.0060L
n=0.0006mol
0.20g样品中FeC2O4的质量分数=
| 0.0006mol×144g/mol |
| 0.20g |
故答案为:43.2%;
点评:本题以草酸亚铁制备为载体,考查盐类水解、化学计算推断物质、化学平衡计算,滴定误差分析判断,根据计算判断各阶段发生的反应是解题的关键,容易忽略草酸亚铁分解生成的一氧化碳、二氧化碳,难度较大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列化学反应的离子方程式正确的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、向氢氧化钠溶液中通入少量CO2:CO2+OH-=HCO3- |
| C、铝片放入NaOH溶液中:2OH-+Al=AlO2-+H2↑ |
| D、往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
下列溶液中有关物质的量浓度关系正确的是( )
| A、0.2mol?L-1的NaHCO3溶液:c(HCO3-)>c(CO32-)>0.1mol?L-1>c(H2CO3) |
| B、pH=2的HCl溶液与pH=12的氨水等体积混合:c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
| C、0.2mol?L-1CH3COOH溶液和0.2mol?L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol?L-1 |
| D、0.1mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO-3)+3c(H2CO3)+2c(H+) |
下列实验能达到目的是( )
A、 用酒精萃取溴水中的溴 |
B、 将硫酸铜溶液直接蒸干得到胆矾 |
C、 说明2NO2(g)?N2O4(g)△H<0 |
D、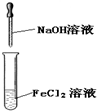 实验室制备Fe(OH)2 |
对100mL 1mol?L-1的Na2CO3溶液,下列说法不正确的是( )
A、将溶液稀释,
| ||
| B、滴入含0.1 mol CH3COOH的溶液:c(CH3COO-)<c(HCO3-) | ||
| C、通入0.1 mol CO2气体,溶液中存在:c(Na+)=c(CO32-)十c(HCO3-)+c(H2CO3) | ||
| D、滴入酚酞,微热,溶液颜色加深 |