题目内容
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑥的离子结构示意图: .
(2)元素⑦中质子数和中子数相等的同位素符号是: .
(3)④、⑤、⑦的离子半径由大到小的顺序为: .
(4)②的最高价氧化物对应水化物的电离方程式为: .
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: .
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: .
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂.已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: .
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)元素⑦中质子数和中子数相等的同位素符号是:
(3)④、⑤、⑦的离子半径由大到小的顺序为:
(4)②的最高价氧化物对应水化物的电离方程式为:
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为:
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为:
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂.已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式:
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题,元素及其化合物
分析:由元素在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为S,⑧为Cl,根据元素化合物知识分析解答.
(1)元素⑥为铝元素,即铝离子的结构示意图;
(2)元素⑦是硫元素,质子数和中子数相等都是16,质量数为32的同位素符号;
(3)微粒电子层越多半径越大,电子排布一样,核电荷数越多半径越小;
(4)元素②是碳元素,最高价氧化对应的水化物是碳酸,是弱酸,分步电离;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成;
(6)5核10电子分子常做燃料电池的燃料是CH4电解呈碱性,负极发生氧化反应.
(7)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气.
(1)元素⑥为铝元素,即铝离子的结构示意图;
(2)元素⑦是硫元素,质子数和中子数相等都是16,质量数为32的同位素符号;
(3)微粒电子层越多半径越大,电子排布一样,核电荷数越多半径越小;
(4)元素②是碳元素,最高价氧化对应的水化物是碳酸,是弱酸,分步电离;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成;
(6)5核10电子分子常做燃料电池的燃料是CH4电解呈碱性,负极发生氧化反应.
(7)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气.
解答:
解:由元素在周期表中的位置可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为S,⑧为Cl,根据元素化合物知识分析解答.
(1)元素⑥为铝元素,即铝离子的结构示意图 故答案为:
故答案为:
(2)元素⑦是硫元素,质子数和中子数相等都是16,质量数为32,同位素符号是
S,故答案为:
S;
(3)微粒电子层越多半径越大,电子排布一样,核电荷数越多半径越小S2->O2->Na+故答案为:S2->O2->Na+;
(4)元素②是碳元素,最高价氧化对应的水化物是碳酸,是弱酸,H2CO3?H++HCO3-故答案为:H2CO3?H++HCO3-,HCO3-=H++CO32-;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为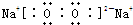 ,故答案为:
,故答案为: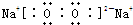 ;
;
(6)5核10电子分子常做燃料电池的燃料是CH4,CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(7)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气,并放出838kJ热量,16gN2H4的物质的量=
mol=0.5mol,0.5molN2H4完全反应放出838kJ热量,则1molA完全反应放出1676kJ燃料,所以其热化学反应方程式为:N2H4(l)+2H2O2(l)=4H2O(l)+N2(g)△H=-1676kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=4H2O(l)+N2(g)△H=-1676kJ/mol.
(1)元素⑥为铝元素,即铝离子的结构示意图
 故答案为:
故答案为:
(2)元素⑦是硫元素,质子数和中子数相等都是16,质量数为32,同位素符号是
|
|
(3)微粒电子层越多半径越大,电子排布一样,核电荷数越多半径越小S2->O2->Na+故答案为:S2->O2->Na+;
(4)元素②是碳元素,最高价氧化对应的水化物是碳酸,是弱酸,H2CO3?H++HCO3-故答案为:H2CO3?H++HCO3-,HCO3-=H++CO32-;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为
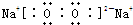 ,故答案为:
,故答案为: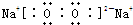 ;
;(6)5核10电子分子常做燃料电池的燃料是CH4,CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(7)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气,并放出838kJ热量,16gN2H4的物质的量=
| 16 |
| 32 |
故答案为:N2H4(l)+2H2O2(l)=4H2O(l)+N2(g)△H=-1676kJ/mol.
点评:本题考查元素化合物的性质,正确推断元素是解本题关键,涉及的知识点较多,难度不大,注意基础知识的积累和运用.

练习册系列答案
相关题目
某混合液中含有等物质的量的CuSO4、FeSO4、Fe2(SO4)3.已知如表数据,下列叙述正确的是( )
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | ≥3~4 |
A、混合溶液中:c(SO
| ||
| B、若向混合溶液中加入铁粉,不可能观察到红色固体析出 | ||
| C、若向混合溶液中加入足量氯水,调节pH到3-4后过滤,得到纯净的CuSO4溶液 | ||
| D、若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀 |
下列离子方程式书写正确的是( )
| A、电解饱和食盐水的阳极反应:2H2O+2e-=H2↑+2OH- | ||
B、碳酸钠溶液呈碱性的原因:CO
| ||
C、向AgNO3溶液中加入过量氨水:Ag++NH3?H2O=AgOH↓+NH
| ||
D、泡沫灭火器反应原理:A12++3HCO
|
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是( )
| A、原子序数X<Y |
| B、原子半径X>Y |
| C、原子的最外层电子数X>Y |
| D、元素的最高正价X<Y |
下列说法正确的是( )
| A、0.5 mol Fe2+与含0.5 mol H2O2溶液反应,转移NA个电子(NA表示阿伏加德罗常数) | ||
B、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
| ||
| C、复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是2 Fe3++3SO42-+3Ba2++6 OH-=3BaSO4↓+2Fe(OH)3↓ | ||
| D、向2mL 0.1mol/L的硝酸银溶液中滴加几滴0.1mol/L氯化钠溶液,产生白色沉淀,再滴加几滴硫化钠溶液,产生黑色沉淀,说明氯化银能转化为更难溶的硫化银 |
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置. 的不饱和度为
的不饱和度为 的系统命名为
的系统命名为 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产.
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产. 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题: