题目内容
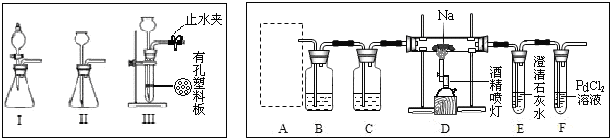
10. A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:
A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,I为具有磁性的黑色晶体,它们有如图所示的转化关系:根据以上转换关系回答:
(1)写出D物质在工业上的两种用途做冶炼金属的原料;做耐火材料.
(2)把A的薄箔卷成筒状在氧气中燃烧的现象是剧烈燃烧,放出大量的热和发出耀眼的白光.
(3)写出反应①的化学方程式4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
(4)写出反应②和③的离子方程式
②2Al+2OH-+2H2O═2AlO2-+3H2↑;
③AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
分析 A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4,由A与D相互转化及A能与氢氧化钠溶液反应,可知A为Al、D为Al2O3,结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3,据此解答.
解答 解:A、B、C均是由短周期元素组成的单质,D、E、F、G、H、I均为化合物,F在常温常压下为液态,由D与盐酸反应得到,可以推断F为H2O,I为具有磁性的黑色晶体,为Fe3O4,由A与D相互转化及A能与氢氧化钠溶液反应,可知A为Al、D为Al2O3,结合转化关系,可推知C为H2、E为NaAlO2、G为Al(OH)3、B为O2、H为AlCl3,
(1)D为氧化铝,能做冶炼金属的原料、做耐火材料,故答案为:做冶炼金属的原料;做耐火材料;
(2)A是Al,铝箔在氧气中剧烈燃烧,放出大量的热和发出耀眼的白光,故答案为:剧烈燃烧,放出大量的热和发出耀眼的白光;
(3)该反应为铝热反应,发生置换反应,反应方程式为4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,故答案为:4Al+3MnO2 $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn;
(4)②离子反应方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
③离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题以Al及其化合物之间的转化为载体考查无机物推断,为高频考点,侧重考查学生分析推断能力,利用物质特殊性为突破口进行推断,注意铝和NaOH溶液反应中NaOH不是氧化剂,为易错点.

| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
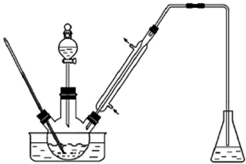 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
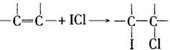
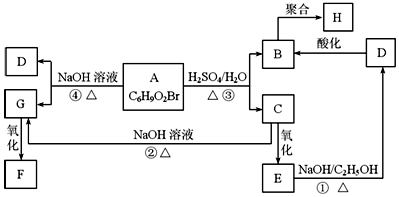 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.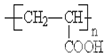 ;
;