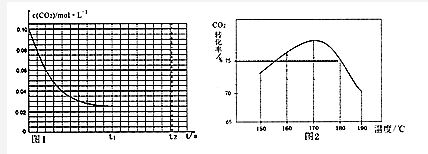
题目内容
10.X、Y、Z、W是原子序数逐渐增大的四种短周期主族元素,其原子半径如下表,已知Y、Z两种元素的单质是空气主要成分,W原子最外层电子数与Ne原子最外层电子数相差1.下列说法正确的是( )| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
分析 X、Y、Z、W是原子序数逐渐增大的四种短周期主族元素,因同周期元素随着原子序数的增大而原子半径逐渐减小,可知X位于第一周期,应为H元素,Y、Z为第二周期,W为第三周期,Y、Z两种元素的单质是空气主要成分,分别为氧气、氮气,可知Y为N元素,Z为O元素,W原子最外层电子数与Ne原子最外层电子数相差1,应为Cl元素,以此解答该题.
解答 解:X、Y、Z、W是原子序数逐渐增大的四种短周期主族元素,因同周期元素随着原子序数的增大而原子半径逐渐减小,可知X位于第一周期,应为H元素,Y、Z为第二周期,W为第三周期,Y、Z两种元素的单质是空气主要成分,分别为氧气、氮气,可知Y为N元素,Z为O元素,W原子最外层电子数与Ne原子最外层电子数相差1,应为Cl元素,
A.由以上分析可知Y、Z为第二周期,W为第三周期,故A错误;
B.因存在可逆反应2NO2?N2O4,则通常状况下得不到纯净的NO2,故B正确;
C.X与Z形成的化合物H2O2含非极性键,故C错误;
D.X、Z、W形成的化合物HClO4为强酸,故D错误.
故选B.
点评 本题考查元素结构与元素周期率知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原子结构与元素周期率的递变规律,把握物质的性质的相似性和递变性,难度中等.

练习册系列答案
相关题目
14.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
则:
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 12.2 | 3.2 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
1.表是元素周期表的一部分,回答下列有关问题:
(1)画出原子的结构示意图:④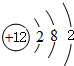 ,⑧
,⑧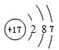
(2)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
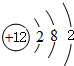 ,⑧
,⑧
(2)第三周期(除稀有气体元素)中原子半径最大的元素是③(填序号),跟它同周期原子半径最小的元素是⑧(填序号)
(3)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)写出实验室制取元素①的气态氢化物最常用的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)元素①的最高价氧化物对应的水化物的浓溶液与单质铜反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
18.下列有关如图装置的说法正确的是( )
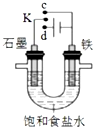

| A. | 若K与c连接,石墨电极的电极反应为:O2+4e-+4H+=2H2O | |
| B. | 若K与c连接,则溶液中的Na+向铁电极移动 | |
| C. | 若K与d连接,铁电极的电极反应为:2H++2e-═H2↑ | |
| D. | 若K与d连接,一段时间后,加适量稀盐酸可使电解质溶液复原 |
5.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
2.短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
19.下列图象能正确表示化学实验的进程或结果的是( )
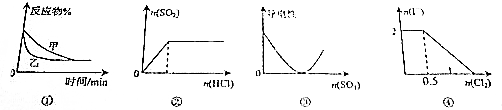

| A. | 图①表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| B. | 图②表示一定浓度的Na2SO3溶液中滴加稀盐酸,生成SO2与HCl的物质的量的关系 | |
| C. | 图③表示在Ba(OH)2溶液中加入SO3至过量的过程中溶液导电性的变化 | |
| D. | 图④表示在1L 1mol•L-1FeI2溶液中,通入Cl2时I-物质的量的变化 |
3.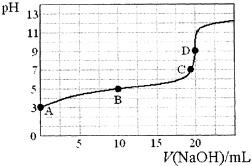 已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )
已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )
 已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )
已知:H3PO2是一元中强酸.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图,则下列说法不正确的是( )| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+ | |
| B. | 常温下,Ka(H3PO2)≈10-5 | |
| C. | 该滴定实验中,用酚酞作指示剂比用甲基橙作指示剂的误差小 | |
| D. | B点溶液中存在关系:c(H+)+c(H3PO2)=c(OH-)+c(H2PO2-) |