题目内容
4.某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+.为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图.请完成下列问题.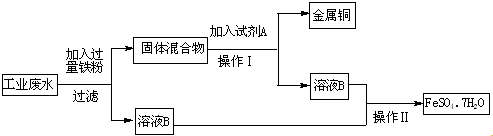
(1)检验工业废水中含有Fe3+的方法是加入KSCN溶液,溶液显血红色.
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为2Fe3++Fe=3Fe2+.
(3)操作Ⅰ为过滤.
分析 (1)铁离子的检验加无色的KSCN溶液,观察溶液的颜色.
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为2Fe3++Fe=3Fe2+;
(3)要分离不溶于水的固体和液体,可用过滤的方法;
解答 解:(1)铁离子的检验加无色的KSCN溶液,观察溶液的颜色是否显血红色,故答案为:加入KSCN溶液,溶液显血红色;
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)根据流程图中可以知道,固体混合物是铁粉、铜,在铁粉、铜中加入适量稀硫酸,稀硫酸和铁粉反应,生成硫酸亚铁,分离不溶于水的固体和液体,用过滤,
故答案为:过滤.
点评 解答本题要充分理解各种物质的性质,从而得出正确的结论,应熟悉混合物的分离方法,掌握过滤和蒸发结晶分离方法的使用条件及实验操作.

练习册系列答案
相关题目
11.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A. | 回收利用金属制品,废旧电池专门回收处理 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 大湖名城,水资源丰富,工业废水和生活污水可任意排放 | |
| D. | 合肥一六八中学开展“校园文明活动”、“光盘行动”、减少使用瓶装水 |
12.在学习了溶液中的离子反应之后,小明同学认为反应中的先后顺序很重要,他们归纳了下面一些情况,在他所作的整理中,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向浓度均为0.1 mol/L的FeBr2通入少量氯气,Br-首先反应 |
12. 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 醋酸中逐滴加入氢氧化钠溶液 | ||
| C. | 氢氧化钡溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
19.下列说法正确的是( )
| A. | 金刚石和石墨互为同位素 | |
| B. | C2H6和C5H12互为同系物 | |
| C. | C2H4和C2H6互为同系物 | |
| D. | CH3CH2CH2CH3和CH3CH(CH3)2互为同系物 |
9.已知:
乙苯催化脱氢制苯乙烯反应: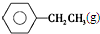 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$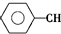 ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
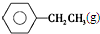 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
16.下列说法不正确的是( )
| A. | 用小苏打(NaHCO3)发酵面团制作馒头 | |
| B. | 干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| C. | 用Al(OH)3治疗胃酸过多 | |
| D. | 光导纤维的主要成分是SiO2 |
13.关于反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O的说法正确的是( )
| A. | Cu是氧化剂 | B. | HNO3在反应中被氧化 | ||
| C. | 每生成1 mol NO转移3 mol e- | D. | HNO3仅表现出酸性 |
14.对热化学方程式:$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)═HI(g)△H=-7.5kJ•mol-1的叙述中,正确的是( )
| A. | 1mol H2(g)和1mol I2(g)完全反应需要吸收15kJ的热量 | |
| B. | 1个氢分子与1个碘分子完全反应放出15kJ的热量 | |
| C. | 1mol H2(g)和1mol I2(g)完全反应放出15kJ的热量 | |
| D. | 0.5mol H2(g)和0.5mol I2(g)完全反应吸收7.5kJ 的热量 |