题目内容
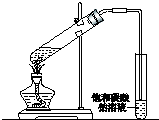
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 、 .
(2)滤渣A的主要成分为 ;实验室过滤时使用玻璃棒,其作用是 .
(3)在工艺流程第三步中,选用二氧化碳作酸化剂,写出通入过量的CO2发生反应的离子方程式: .
(4)若将铝用酸溶解,下列试剂中最好选用 (填编号).
A.浓硫酸 B.稀硫酸 C.稀硝酸
(5)写出用NaOH溶液溶解铝的化学方程: .

已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式:
(2)滤渣A的主要成分为
(3)在工艺流程第三步中,选用二氧化碳作酸化剂,写出通入过量的CO2发生反应的离子方程式:
(4)若将铝用酸溶解,下列试剂中最好选用
A.浓硫酸 B.稀硫酸 C.稀硝酸
(5)写出用NaOH溶液溶解铝的化学方程:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,过滤利用玻璃棒引流;
(3)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀;
(4)根据Al的化学性质及不生成有毒气体来解答;
(5)铝和氢氧化钠的反应生成偏铝酸钠和氢气.
(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,过滤利用玻璃棒引流;
(3)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀;
(4)根据Al的化学性质及不生成有毒气体来解答;
(5)铝和氢氧化钠的反应生成偏铝酸钠和氢气.
解答:
解:(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,离子反应分别为Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8,过滤利用玻璃棒引流,
故答案为:Fe2O3、Na2Al2Si2O8;引流;
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,所以第三步中,选用二氧化碳作酸化剂的原因为将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
故答案为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(4)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(5)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑.
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8,过滤利用玻璃棒引流,
故答案为:Fe2O3、Na2Al2Si2O8;引流;
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,所以第三步中,选用二氧化碳作酸化剂的原因为将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
故答案为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(4)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(5)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为2Al+2H2O+2NaOH═2NaAlO2+3H2↑,故答案为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑.
点评:本题考查A及其化合物的化学性质,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

练习册系列答案
相关题目
下列每组反应一定能用同一离子方程式表示的是( )
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
下列有关化学用语使用正确的是( )
| A、丙烯的结构简式:C3H6 |
B、3-甲基-1-丁烯的结构简式: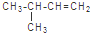 |
C、HOCH2COOH缩聚物的结构简式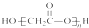 |
D、苯甲醛: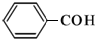 |
 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白. 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子最外层电子数之和.另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子.请回答下列问题.