题目内容
下列化学反应的离子方程式正确的是( )
| A、往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀Al3++2 SO42-+2 Ba2++4 OH-=2 BaSO4↓+AlO2-+2 H2O |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C、用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D、AgNO3溶液中加入过量的氨水:Ag++NH3?H2O=AgOH↓+NH4+ |
考点:离子方程式的书写
专题:
分析:A.明矾为KAl(SO4)2,硫酸根离子恰好沉淀完全,则硫酸铝钾与氢氧化钡按照物质的量1:2反应,铝离子与氢氧根离子的物质的量之比为1:4,恰好生成偏铝酸根离子;
B.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
C.稀硝酸能够将亚铁离子氧化成铁离子、将硫化氢氧化成硫单质;
D.氨水过量,氢氧化银沉淀溶解生成银氨溶液,不会生成沉淀.
B.次氯酸具有强氧化性,能够将亚硫酸钙氧化成硫酸钙;
C.稀硝酸能够将亚铁离子氧化成铁离子、将硫化氢氧化成硫单质;
D.氨水过量,氢氧化银沉淀溶解生成银氨溶液,不会生成沉淀.
解答:
解:A.往明矾溶液中逐滴加入氢氧化钡溶液至SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡按照物质的量1:2反应,铝离子与氢氧根离子的物质的量之比为1:4,反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故A正确;
B.次氯酸根离子能够将亚硫酸钙氧化成硫酸钙,正确的离子方程式为:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO,故B错误;
C.用稀HNO3溶解FeS固体,亚铁离子和硫离子都会被硝酸氧化,正确的离子方程式为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.银离子与少量氨水反应生成氢氧化银沉淀和铵根离子:Ag++NH3?H2O═AgOH↓+NH4+,氨水过量,则氢氧化银和氨水反应生成银氨溶液和水:AgOH+2NH3?H2O═Ag(NH3)2++OH?+2H2O,故D错误;
故选A.
B.次氯酸根离子能够将亚硫酸钙氧化成硫酸钙,正确的离子方程式为:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO,故B错误;
C.用稀HNO3溶解FeS固体,亚铁离子和硫离子都会被硝酸氧化,正确的离子方程式为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.银离子与少量氨水反应生成氢氧化银沉淀和铵根离子:Ag++NH3?H2O═AgOH↓+NH4+,氨水过量,则氢氧化银和氨水反应生成银氨溶液和水:AgOH+2NH3?H2O═Ag(NH3)2++OH?+2H2O,故D错误;
故选A.
点评:本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、1molNa2CO3 中Na+ 的物质的量为1mol |
| C、1mol某气体的体积为22.4L |
| D、标准状况下,1g H2和 11.2LO2的物质的量相等 |
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
下列说法中正确的是( )
| A、标准状况下,32gO2占有的体积约为22.4L |
| B、氢气的摩尔质量是2g |
| C、在标准状况下,22.4L水的质量为18g |
| D、1molH2O的质量是18g/mol |
下列每组反应一定能用同一离子方程式表示的是( )
| A、CaCO3、Na2CO3分别与盐酸反应 |
| B、CuO分别与稀硫酸、稀盐酸、稀硝酸反应 |
| C、H2SO4、K2SO4溶液分别与Ba(OH)2溶液反应 |
| D、Na分别与水、稀盐酸反应 |
下列有关化学用语使用正确的是( )
| A、丙烯的结构简式:C3H6 |
B、3-甲基-1-丁烯的结构简式: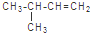 |
C、HOCH2COOH缩聚物的结构简式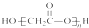 |
D、苯甲醛: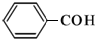 |
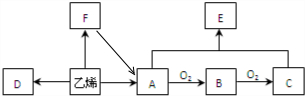
 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.