题目内容
6.过氧化氢在下列三个反应中:①H2O2+H2S═2H2O+S↓、②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、③H2O2+Cl2═2HCl+O2,所起的作用是( )| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
分析 ①H2O2+H2S═2H2O+S↓中O元素的化合价降低,S元素的化合价升高;
②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑中O元素的化合价升高也降低;
③H2O2+Cl2═2HCl+O2中O元素的化合价升高,Cl元素的化合价降低,以此来解答.
解答 解:①中过氧化氢作氧化剂,②中过氧化氢作氧化剂和还原剂,③中过氧化氢作还原剂,所起的作用不同,
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.浓度为0.1mol/L的HCl溶液VmL,加水稀释到2VmL,取出10mL,这10mL溶液中含有c(H+)( )
| A. | 0.5mol/L | B. | 0.01mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
17.下列表格中各项都正确的一组是( )
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 明矾 | 食盐 | 石墨 | 醋酸 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| D | KOH | CuSO4 | Na2SO4 | NaClO |
| A. | A | B. | B | C. | C | D. | D |
1.下列反应属于非氧化还原反应的是( )
| A. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2 Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4Fe (OH)2+O2+2H2O═4Fe(OH)3 |
11.在某容积为2L的密闭容器内加入0.2mol的CO和0.1mol的H2O,在催化剂存在的条件下高温加热发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
12.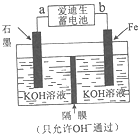 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①反应达到平衡后,再通入一定量的氩气,则CO的转化率将不变(填“增大”、“减小”、“不变”);
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
13.下列过程没有发生化学反应的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用活性炭去除冰箱中的异味 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |