题目内容
11.在某容积为2L的密闭容器内加入0.2mol的CO和0.1mol的H2O,在催化剂存在的条件下高温加热发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H=akJ/mol(a>0)达到平衡后测得c(CO):c(CO2)=3:2,下列说法正确的是( )| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
分析 设达到平衡时,CO转化xmol,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol(0.2-x)mol xmol xmol
根据在同一容器中浓度之比等于物质的量之比,c(CO):c(CO2)=3:2,则有(0.2-x):x=3:2,
x=0.08mol,
以此对各选项进行分析.
解答 解:设达到平衡时,CO转化xmol,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol(0.2-x)mol xmol xmol
根据在同一容器中浓度之比等于物质的量之比,c(CO):c(CO2)=3:2,则有(0.2-x):x=3:2,
x=0.08mol,
A、反应吸收的热量为0.08akJ,故A错误;
B、平衡时H2O的转化率为CO转化率的相等,故B错误;
C、正反应是吸热反应,若改变条件,K增大,所以只能升高温度,而体积和气体的总物质的量不变,则压强增大,故C正确;
D、将容器的体积压缩为1L,两边气体的计量数相等,则该平衡不移动,故D错误;
故选:C.
点评 本题考查化学平衡的计算,题目难度中等,解答本题的关键是根据浓度关系计算平衡时各物质的物质的量,注意利用三段式法计算较为直观,本题有利于调动学生的学习兴趣和学习积极性,能够提高学生灵活应用所学知识的能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
1.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-.据此判断,以下叙述错误的是( )
| A. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| B. | 液氨中含有NH3、NH4+、NH2-等粒子 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
19.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
6.过氧化氢在下列三个反应中:①H2O2+H2S═2H2O+S↓、②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、③H2O2+Cl2═2HCl+O2,所起的作用是( )
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
18.下图所示的实验操作正确的是( )
| A. |  取用药品 | B. |  给试管加热 | ||
| C. |  滴加溶液 | D. |  称量氢氧化钠固体 |
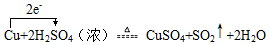 .实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.
.实验测得,反应中生成了标准状况下的SO2气体44.8L,则耗氧化剂的物质的量为2mol.