题目内容
12. 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:(1)地壳中含量最多的金属元素的单质与氧化铁在高温下发生反应可用于焊接钢轨,该反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
则反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H=-24.8kJ•mol-1.
(3)在T℃、2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②若甲容器中CO的平衡转化率为60%,则T℃时,反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的平衡常数K=64;
③下列说法正确的是B
A.若容器压强恒定,反应达到平衡状态
B.若容器内混合气体密度恒定,反应达到平衡状态
C.甲、乙容器中CO的平衡转化率相等
D.增加Fe2O3粉末的物质的量就能提高CO的转化率
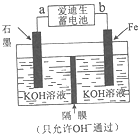
(4)铁与金属镍在碱性条件下可形成二次电池,俗称爱迪生蓄电池.利用爱迪生蓄电池可以制取少量高锰酸钾(装置如图所示),此装置中负极是a(填“a”或“b”),写出阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4时,电路中转移的电子的物质的量为0.6mol.
分析 (1)地壳中含量最多的金属元素是铝元素,利用其单质铝与氧化铁在高温下发生反应生成铁和氧化铝来焊接钢轨;
(2)根据盖斯定律计算反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g)的△H;
(3)①在T℃时,恒容密闭容器,再通入一定量的N2,虽然压强增大了,但反应物和生成物的浓度都没有变化,所以平衡不移动;
②若甲容器中CO的平衡转化率为60%,则T℃时,依据平衡三段式结合平衡常数的表达式列式计算;
③A.反应前后气体物质的量不变,说明压强也一直不变,若容器压强恒定,不能标志反应达到平衡状态;
B.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
C.乙容器中一氧化碳增加,平衡虽然向正方向移动,但由于只增加一氧化碳的量,所以一氧化碳的转化率仍然变低,故甲容器中CO的平衡转化率不等于乙的转化率;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
(4)放电时,铁棒作负极,碳棒作正极,据此判断a的电极;铁失电子和氢氧根离子生成高铁酸根离子和水;当生成19.8g的K2FeO4即0.1mol时,再根据阳极电极反应式可知转移电子为0.6mol.
解答 解:(1)铝与氧化铁发生铝热反应焊接钢轨的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)①CO(g)+FeO(s)=CO2(g)+Fe(s)△H=-218.03kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
根据盖斯定律可知①×2+②+③×$\frac{2}{3}$得反应Fe2O3(s)+3CO(g)?2Fe (s)+3CO2(g),△H=(-218.03kJ•mol-1)×2+
(-47.2kJ•mol-1)+(+640.5kJ•mol-1)×$\frac{2}{3}$=-24.8kJ•mol-1,故答案为:-24.8kJ•mol-1;
(3)①在T℃时,恒容密闭容器,再通入一定量的N2,虽然压强增大了,但反应物和生成物的浓度都没有变化,所以平衡不移动,所以CO的转化率将不变,
故答案:不变;
②若甲容器中CO的平衡转化率为60%,则T℃时,
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) 0.6 0.6
平衡量(mol) 0.4 1.6
K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$=$\frac{(1.6mol/L)^{3}}{(0.4mol/L)^{3}}$=64,
故答案为:64;
③A.反应前后气体物质的量不变,说明压强也一直不变,若容器压强恒定,不能标志反应达到平衡状态,故A错误;
B.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故B正确;
C.乙容器中一氧化碳增加,平衡虽然向正方向移动,但由于只增加一氧化碳的量,所以一氧化碳的转化率仍然变低,故甲容器中CO的平衡转化率不等于乙的转化率,故C错误;
D.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故D错误;
故答案为:B;
(4)放电时,铁作负极,碳棒作正极,所以放电时a是负极,b是正极;阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O;当生成19.8g的K2FeO4即0.1mol时,再根据阳极电极反应式可知转移电子为0.6mol,
故答案为:a;Fe-6e-+8OH-=FeO42-+4H2O;0.6mol.
点评 本题考查盖斯定律的应用、平衡常数的计算、平衡移动等知识点还以安迪生电池为载体考查了原电池原电池和电解池原理,难度不大,明确高铁酸钠能作为一种新型净水剂的原理.

| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度
B.移出部分CO2
C.加入合适的催化剂
D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006 mol•L-1•min-1.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
| A. | 1mol镁原子中含有的电子数为2NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
 CO2与H2合成甲醚的主要反应如下:
CO2与H2合成甲醚的主要反应如下: