题目内容
14.某混合溶液所含离子的浓度如下表,则M离子可能为( )| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
分析 任何电解质溶液中都呈电中性,溶液中阴阳离子所带电荷相等,根据阴阳离子所带电荷相等确定M所带电荷及浓度,据此分析解答.
解答 解:任何电解质溶液中都呈电中性,溶液中阴阳离子所带电荷相等,溶液中c(NO3-)+2c(SO42-)=2mol/L+2×1mol/L=4mol/L,c(H+)=2mol/L<c(NO3-)+2c(SO42-)=4mol/L,所以M带正电荷,根据表中数据知,c(M)=1mol/L,c(M)=c(NO3-)+2c(SO42-)-c(H+)=4mol/L-2mol/L=2mol/L,则M应该带2个单位正电荷,且不能和硫酸根离子和硝酸根离子反应,硫酸根和钡离子不能共存,
故选A.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析判断及计算能力,明确电荷守恒、离子共存是解本题关键,易错选项是B.

练习册系列答案
相关题目
4.在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)?2HI(g)△H<0.则下列叙述中不正确的是( )
| A. | 保持容器容积不变,向其中再加入1mol H2,反应速率加快,理由是增大反应物氢气的浓度,反应速率加快 | |
| B. | 保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应),反应速率减慢,理由是保持压强不变,向其中充入N2,体积变大,反应物浓度减小,反应速率减慢 | |
| C. | 保持容器容积不变,向其中加入1mol N2(N2不参加反应),反应速率不变,理由是反应物的浓度不变,反应速率不变 | |
| D. | 保持容器内气体压强不变,向其中再加入1mol H2(g)和1mol I2(g),反应速率减小,理由是容器体积变大反应物浓度变小,反应速率减小 |
5.在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g)?3C(g)+D(g),平衡时C的浓度为amol•L-1.若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol•L-1的是( )
| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
19.在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
6.过氧化氢在下列三个反应中:①H2O2+H2S═2H2O+S↓、②2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、③H2O2+Cl2═2HCl+O2,所起的作用是( )
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
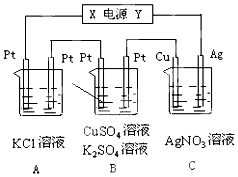 如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答: