题目内容
下列离子方程式正确的是( )
| A、氨水与AlCl3溶液发生反应的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| B、硫化钠水解:S2-+2H2O?H2S↑+2OH- |
| C、制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
| D、硫酸铝溶液跟四羟基合铝酸钠溶液反应:Al3++3[Al(OH)4]-═4Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氨水为弱碱,一水合氨不能拆开;
B.铝离子的水解分步进行,且水解程度较小,主要以第一步为主;
C.铁离子水解生成氢氧化铁胶体,反应需要加热,不能使用沉淀符号;
D.铝离子与四羟基合铝酸钠溶液发生双水解反应生成氢氧化铝沉淀.
B.铝离子的水解分步进行,且水解程度较小,主要以第一步为主;
C.铁离子水解生成氢氧化铁胶体,反应需要加热,不能使用沉淀符号;
D.铝离子与四羟基合铝酸钠溶液发生双水解反应生成氢氧化铝沉淀.
解答:
解:A.氨水与AlCl3溶液发生反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4,故A错误;
B.硫离子的水解程度较小,其水解以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故B错误;
C.书写胶体的离子方程式时Fe(OH)3不是沉淀,正确是的:Fe3++3H2O
Fe(OH)3(胶体)+3H+,故C错误;
D.硫酸铝溶液跟四羟基合铝酸钠溶液发生双水解反应,反应的离子方程式为为:Al3++3[Al(OH)4]-═4Al(OH)3↓,故D正确;
故选D.
B.硫离子的水解程度较小,其水解以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故B错误;
C.书写胶体的离子方程式时Fe(OH)3不是沉淀,正确是的:Fe3++3H2O
| ||
D.硫酸铝溶液跟四羟基合铝酸钠溶液发生双水解反应,反应的离子方程式为为:Al3++3[Al(OH)4]-═4Al(OH)3↓,故D正确;
故选D.
点评:本题考查了离子方程式的书写,题目难度中等,注意掌握盐的水解原理、离子方程式的书写原则,明确制备氢氧化铁胶体的方法,为易错点.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列实验方案设计可行的是( )
| A、用洁净的铂丝蘸取KCl溶液,在酒精灯火焰上燃烧,观察钾的焰色 |
| B、通过加热的方法将NaHCO3固体和NH4Cl固体分离 |
| C、用浓硫酸干燥SO2 |
| D、将过量的SO2通往石蕊试液,验证SO2的漂白性 |
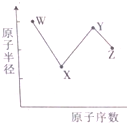 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
将下列固体溶于水,再讲其溶液加热蒸发,结晶后再灼烧,得到的固体与原固体物质相同的是( )
①硫酸铝 ②胆矾 ③FeCl3 ④小苏打 ⑤碳酸铵 ⑥次氯酸钠 ⑦硫酸亚铁.
①硫酸铝 ②胆矾 ③FeCl3 ④小苏打 ⑤碳酸铵 ⑥次氯酸钠 ⑦硫酸亚铁.
| A、①②④⑦ | B、②⑥ |
| C、③⑤ | D、只有① |
下列说法正确的是( )
| A、可用碱式滴定管量取12.85 mL的KMnO4溶液 |
| B、测定氯水的pH,用干燥洁净的玻璃棒蘸取该溶液滴在湿润的pH试纸上 |
| C、反应物的总能量低于生成物的总能量时,一定不能自发进行反应 |
| D、由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.