题目内容
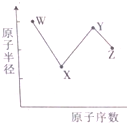 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:由短周期元素W、X、Y和Z的原子半径随原子序数的变化,可知W、X处于第二周期,Y、Z处于第三周期,元素Y是地壳中含量最丰富的金属元素,则Y为Al;元素Z的原子最外层电子数是其电子层数的2倍,其最外层电子数为6,故Z为S元素;在周期表中,W和X的族序数之和等于Z的族序数,且X的单质是空气的成分之一,结合原子半径W>Al,则W为Li元素,X处于ⅤA族,故X为N元素,据此解答.
解答:
解:由短周期元素W、X、Y和Z的原子半径随原子序数的变化,可知W、X处于第二周期,Y、Z处于第三周期,元素Y是地壳中含量最丰富的金属元素,则Y为Al;元素Z的原子最外层电子数是其电子层数的2倍,其最外层电子数为6,故Z为S元素;在周期表中,W和X的族序数之和等于Z的族序数,且X的单质是空气的成分之一,结合原子半径W>Al,则W为Li元素,X处于ⅤA族,故X为N元素,
A.W的简单离子为Li+,Li+与H-电子层结构相同,核电荷数越大离子半径越小,故离子半径Li+<H-,故A正确;
B.Y与Z形成的化合物为Al2S3,能发生水解反应生成氢氧化铝与硫化氢,不能通过溶液中复分解获取,故B错误;
C.Al再浓硫酸中发生钝化现象,可以用铝制容器运输浓硫酸,故C正确;
D.氨气分子之间存在氢键,其沸点高于硫化氢,故D正确,
故选B.
A.W的简单离子为Li+,Li+与H-电子层结构相同,核电荷数越大离子半径越小,故离子半径Li+<H-,故A正确;
B.Y与Z形成的化合物为Al2S3,能发生水解反应生成氢氧化铝与硫化氢,不能通过溶液中复分解获取,故B错误;
C.Al再浓硫酸中发生钝化现象,可以用铝制容器运输浓硫酸,故C正确;
D.氨气分子之间存在氢键,其沸点高于硫化氢,故D正确,
故选B.
点评:本题考查结构性质位置关系综合应用,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
下列有关实验的说法正确的是( )
| A、中和滴定时,用待测溶液润洗锥形瓶 |
| B、使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
| C、PH=2的醋酸溶液加水稀释100倍后,PH=4 |
| D、在配制的硫酸亚铁溶液常加入一定量的铁粉和稀硫酸 |
下列属于现代化学的重大成就的是( )
| A、建立燃烧现象的氧化学说 |
| B、提出化学元素的概念 |
| C、提出原子学说 |
| D、放射性元素的发现 |
在实验室中,对下列实验事故或药品的处理正确的是( )
| A、钠着火时,立即用水灭火 |
| B、加热液体的试管口不能正对着自己或别人 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗 |
| D、实验室中含硫酸的废液可以直接倒入水槽,用水冲入下水道 |
下列离子方程式正确的是( )
| A、氨水与AlCl3溶液发生反应的离子方程式为 Al3++3OH-=Al(OH)3↓ |
| B、硫化钠水解:S2-+2H2O?H2S↑+2OH- |
| C、制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
| D、硫酸铝溶液跟四羟基合铝酸钠溶液反应:Al3++3[Al(OH)4]-═4Al(OH)3↓ |




 (Ⅰ) 水的电离平衡曲线如图所示.
(Ⅰ) 水的电离平衡曲线如图所示.