题目内容
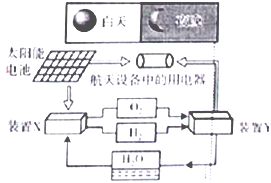 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
考点:化学电源新型电池
专题:电化学专题
分析:A.该系统中存在光能、电能、化学能以及机械能的转化;
B.装置Y为原电池装置,负极发生氧化反应;
C.装置X为电解池,电解生成氧气和氢气;
D.化学能与电能间不可能完全转化.
B.装置Y为原电池装置,负极发生氧化反应;
C.装置X为电解池,电解生成氧气和氢气;
D.化学能与电能间不可能完全转化.
解答:
解:A.系统中存在光能-→电能、电能-→化学能、化学能-→电能、电能-→机械能等多种能量转化方式,故A错误;
B.Y中负极的电极反应式为H2-2e-=2H+,故B错误;
C.装置X可电解水生成H2和O2,能实现燃料电池的燃料和氧化剂再生,故C正确;
D.无论是原电池还是电解池都不可能实现电能与化学能的完全转化,故D错误.
故选C.
B.Y中负极的电极反应式为H2-2e-=2H+,故B错误;
C.装置X可电解水生成H2和O2,能实现燃料电池的燃料和氧化剂再生,故C正确;
D.无论是原电池还是电解池都不可能实现电能与化学能的完全转化,故D错误.
故选C.
点评:本题综合考查电解池和原电池知识,侧重于电池工作原理的考查,注意能量转化形式以及电极方程式的书写.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
下列离子方程式表达正确的是( )
| A、向AgCl悬浊液中加入KI溶液:Ag++I-=AgI↓ |
| B、向Ba(OH)2溶液中滴加少量CuSO4溶液:Ba2++SO42-=BaSO4↓ |
| C、向Ca(HCO3)2溶液中滴加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向NaClO的碱性溶液中滴加少量CoCl2生成Co(OH)3沉淀:2Co2++ClO-+5H2O=2Co(OH)3↓+Cl-+4H+ |
室温下,对于pH和体积均相同的醋酸和盐酸两种溶液,分别采取下列措施,有关叙述正确的是( )
| A、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、温度都升高20℃后,两溶液的pH均不变 |
| C、加水稀释两倍后,两溶液的pH均减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、1 mol 氯气与足量氢氧化钠溶液完全反应,转移电子数目为2NA |
| B、14g氮气中含有14 NA个原子 |
| C、1L1.00 mol/L的Na2SO4溶液中Na+离子数目为2NA |
| D、11.2 L氢气中含有NA个氢原子 |
 目前市售LED晶片,材质基本以GaAs(砷化镓)为主.已知镓、砷分别是铝、磷同主族下一周期的元素.砷化镓的晶胞结构如图所示.试回答:
目前市售LED晶片,材质基本以GaAs(砷化镓)为主.已知镓、砷分别是铝、磷同主族下一周期的元素.砷化镓的晶胞结构如图所示.试回答:

