题目内容
有下列一组物质:He、Cl2、CH4、Na2O2、Ba(OH)2、NO2、KNO3、H2SO4,请从中选择,用化学式填写下列空白:
(1)只含有共价键,不含其他化学键的化合物有 ;
(2)既含有共价键又含有离子键的物质有 ;
(3)能在水中发生氧化还原反应的有 .
(1)只含有共价键,不含其他化学键的化合物有
(2)既含有共价键又含有离子键的物质有
(3)能在水中发生氧化还原反应的有
考点:化学键,氧化还原反应
专题:氧化还原反应专题,化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;能和水发生化学反应,且有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答:
解:(1)非金属元素之间易形成共价键,CH4、NO2、H2SO4 中只含共价键不含其它化学键,且是化合物,故答案为:CH4、NO2、H2SO4;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,Na2O2、Ba(OH)2、KNO3中既含有共价键又含有离子键,故答案为:Na2O2、Ba(OH)2、KNO3;
(3)Na2O2、NO2、Cl2和水反应的方程式分别为:2Na2O2+2H2O=O2↑+4NaOH、3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO,这几个中有元素化合价变化,所以是氧化还原反应,故答案为:Na2O2、NO2、Cl2.
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,Na2O2、Ba(OH)2、KNO3中既含有共价键又含有离子键,故答案为:Na2O2、Ba(OH)2、KNO3;
(3)Na2O2、NO2、Cl2和水反应的方程式分别为:2Na2O2+2H2O=O2↑+4NaOH、3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO,这几个中有元素化合价变化,所以是氧化还原反应,故答案为:Na2O2、NO2、Cl2.
点评:本题考查化学键、氧化还原反应等基本概念,根据定义来分析解答即可,注意氦气中不含化学键,为易错点.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
把一定质量的NaCl在小烧杯中完全溶解后,再将溶液全部转移到500mL的容量瓶中,用蒸馏水稀释至刻度线.摇匀后,从中取出溶液100mL,该溶液恰好与20mL 0.100mol?L-1AgNO3溶液完全反应,则最初溶解的NaCl的质量是( )
| A、0.117 |
| B、0.351g |
| C、0.585g |
| D、0.234g |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、78g苯中含有碳碳双键3NA个 |
| B、1mol甲基(-CH3)含有电子数为10NA个 |
| C、14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、在标准状况下,11.2L辛烷中的碳原子数为4 NA个 |
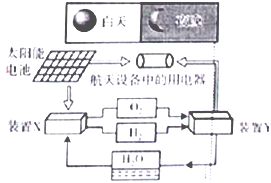 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列化学用语或说法正确的是( )
| A、次氯酸的结构式:H-Cl-O |
| B、CCl4、CS2、NCl3中所有原子都满足最外层为8个电子的稳定结构 |
C、对硝基苯酚的结构简式为 |
D、聚丙烯的结构简式为 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B、无色透明的溶液中:Ba2+、H+、MnO4-、Br- |
| C、使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- |
| D、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、澄清的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- | ||
C、
| ||
| D、c(I-)=0.1 mol?L-1的溶液中:Na+、H+、ClO-、SO42- |