题目内容
室温下,对于pH和体积均相同的醋酸和盐酸两种溶液,分别采取下列措施,有关叙述正确的是( )
| A、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B、温度都升高20℃后,两溶液的pH均不变 |
| C、加水稀释两倍后,两溶液的pH均减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |
考点:弱电解质在水溶液中的电离平衡,溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
解答:
解:A.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故A正确;
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,故C错误;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误;
故选A.
B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,故C错误;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误;
故选A.
点评:本题考查弱电解质电离,易错选项是B,注意对于相同浓度的盐酸和醋酸溶液,升高温度,盐酸的pH不变,但醋酸的pH改变,为易错点.

练习册系列答案
相关题目
在MgCl2和AlCl3的混合溶液中,Cl-的物质的量为0.7mol.向该溶液中逐渐加入100mL 8mol/L的KOH溶液,使之充分反应.反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x.(不考虑Mg2+和Al3+水解及水电离对离子数目的影响),以下叙述正确的是( )
| A、x的取值范围是0<x≤0.25 | ||
| B、无论x为何值,当加入87.5 mL的KOH时,溶液中的阳离子恰好完全沉淀 | ||
| C、当100 mL KOH刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为0.2 | ||
D、若反应前Al3+的物质的量为a mol,则a=
|
某温度下HF的电离常数Ka=3.3×10-4 mol?L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol?L-1)3.在该温度下将浓度为0.31mol?L-1的HF溶液与浓度为0.0O2 mol?L-1的CaCl2溶液等体积混合.下列说法正确的是( )
| A、该温度下,0.31 mol?L-1 HF溶液的pH=2 |
| B、升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C、两溶液混合后不会产生沉淀 |
| D、向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前小 |
把一定质量的NaCl在小烧杯中完全溶解后,再将溶液全部转移到500mL的容量瓶中,用蒸馏水稀释至刻度线.摇匀后,从中取出溶液100mL,该溶液恰好与20mL 0.100mol?L-1AgNO3溶液完全反应,则最初溶解的NaCl的质量是( )
| A、0.117 |
| B、0.351g |
| C、0.585g |
| D、0.234g |
已知:①C(s)+
O2(g)═CO(g)△H=-110.5kJ/mol??
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol??
③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol??
下列说法正确的是( )
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、将2.4 g碳完全转化为水煤气,然后再燃烧,整个过程△H=-78.7 kJ/mol?? |
| B、H的燃烧热为241.8 kJ/mol?? |
| C、由反应②可推知,CO具有还原性而没有氧化性 |
| D、由反应③可知,反应过程中转移5 mol电子且生成液态水时放出的热量小于604.5 kJ |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、78g苯中含有碳碳双键3NA个 |
| B、1mol甲基(-CH3)含有电子数为10NA个 |
| C、14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、在标准状况下,11.2L辛烷中的碳原子数为4 NA个 |
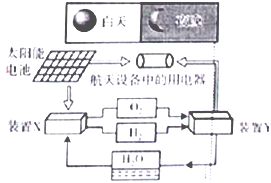 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
 向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I
向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I