题目内容
化合物G是冶炼某常见金属的原料,工业上提取G的流程如下图所示(已知晶体E的焰色反应呈黄色):
(1)溶液A为 溶液(用化学式表示,下同),赤泥浆C的主要成分有 ,
(2)操作Ⅰ为 ;操作Ⅱ为 ,
(3)写出由B生产F的离子方程式为 ,
(4)苛化试剂与E溶液反应生成溶液A,则苛化试剂是 ,该工艺的优点是
(答一条,合理即可).

(1)溶液A为
(2)操作Ⅰ为
(3)写出由B生产F的离子方程式为
(4)苛化试剂与E溶液反应生成溶液A,则苛化试剂是
考点:无机物的推断,制备实验方案的设计
专题:元素及其化合物
分析:赤泥浆C应为Fe2O3,晶体E为Na2CO3?10H2O,溶液B中通入CO2可得到沉淀,且化合物G是冶炼某常见金属的原料,可知B为NaAlO2溶液,D为NaHCO3,F为Al(OH)3,G为Al2O3,则A为NaOH,结合相关物质的性质以及转化关系可解答该题.
解答:
解:赤泥浆C应为Fe2O3,晶体E为Na2CO3?10H2O,溶液B中通入CO2可得到沉淀,且化合物G是冶炼某常见金属的原料,可知B为NaAlO2溶液,D为NaHCO3,F为Al(OH)3,G为Al2O3,则A为NaOH,则
(1)由以上分析可知A为NaOH,C为Fe2O3,故答案为:NaOH;Fe2O3;
(2)操作Ⅰ为溶液和固体的分离,可用过滤方法,Al(OH)3在高温下分解生成Al2O3,则操作Ⅱ为灼烧,
故答案为:过滤; 灼烧(或加热);
(3)NaAlO2生产Al(OH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)E为Na2CO3?10H2O,可与石灰或熟石灰(CaO、Ca(OH)2)反应生成NaOH,该工艺用到石灰或熟石灰,较为廉价,且产物Na2CO3和CaCO3可循环利用,
故答案为:石灰或熟石灰(CaO、Ca(OH)2);苛化试剂经济(或产物得到了循环利用).
(1)由以上分析可知A为NaOH,C为Fe2O3,故答案为:NaOH;Fe2O3;
(2)操作Ⅰ为溶液和固体的分离,可用过滤方法,Al(OH)3在高温下分解生成Al2O3,则操作Ⅱ为灼烧,
故答案为:过滤; 灼烧(或加热);
(3)NaAlO2生产Al(OH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)E为Na2CO3?10H2O,可与石灰或熟石灰(CaO、Ca(OH)2)反应生成NaOH,该工艺用到石灰或熟石灰,较为廉价,且产物Na2CO3和CaCO3可循环利用,
故答案为:石灰或熟石灰(CaO、Ca(OH)2);苛化试剂经济(或产物得到了循环利用).
点评:本题考查无机物的推断,侧重于物质的分离和制备的考查,题目难度不大,本题中明确各物质的种类为解答该题的关键,注意把握相关物质的性质的异同,学习中注意把握常见化学实验操作方法.

练习册系列答案
相关题目
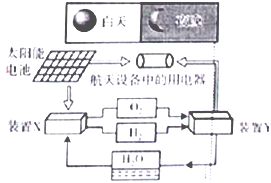 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A、H+、Fe2+、Cr2O72-、SO42- |
| B、Al3+、Na+、SO42-、HCO3- |
| C、Na+、Cu2+、Cl-、S2- |
| D、Fe3+、K+、SCN-、Cl- |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、澄清的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- | ||
C、
| ||
| D、c(I-)=0.1 mol?L-1的溶液中:Na+、H+、ClO-、SO42- |
下列化学用语或说法正确的是( )
| A、向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| B、向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、由水电离的c(H+)为10-13mol/L的溶液,Na+、NO3-、SO42-、I-一定能大量共存 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
 向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I
向FeI溶液中不断通入Cl2,溶液中I-、Cl-、I