题目内容
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.如图所示是用过氧化氢法生产亚氯酸钠的工艺流程图:

已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
(1)吸收塔内发生反应的化学方程式为 (配平化学方程式).该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为 克.
(2)从滤液中得到的NaClO2?3H2O晶体的操作依次是 (填写序号).a.蒸馏;b.灼烧;c.过滤;d.冷却结晶.
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为 ;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是 ;当最后一种离子沉淀完全时(该离子浓度为10-5mol?L-1)此时的S2-的浓度为 .
已知Ksp(FeS)=6.3×10-18(mol?L-1)2,Ksp(CuS)=6×10-36(mol?L-1)2Ksp(PbS)=2.4×10-28(mol?L-1)2.

已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O.
(1)吸收塔内发生反应的化学方程式为
(2)从滤液中得到的NaClO2?3H2O晶体的操作依次是
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是
已知Ksp(FeS)=6.3×10-18(mol?L-1)2,Ksp(CuS)=6×10-36(mol?L-1)2Ksp(PbS)=2.4×10-28(mol?L-1)2.
考点:化学方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯的基本方法选择与应用
专题:
分析:(1)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,Cl元素化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此配平书写方程式;
反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移计算氧化剂与还原剂的物质的量之比,据此确定还原产物与氧化产物物质的量之比,计算还原反应生成的氯气,再根据m=nM计算;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(3)①、弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,故溶液碱性越强,氢离子浓度越小,含有阴阳离子总数的越小;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀;根据溶度积计算S2-的浓度.
反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移计算氧化剂与还原剂的物质的量之比,据此确定还原产物与氧化产物物质的量之比,计算还原反应生成的氯气,再根据m=nM计算;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(3)①、弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,故溶液碱性越强,氢离子浓度越小,含有阴阳离子总数的越小;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀;根据溶度积计算S2-的浓度.
解答:
解:(1)(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),故n(ClO2):n(HCl)=1:4,故还原产物与氧化产物物质的量之比为1:4,故还原反应生成的氯气为5mol×
=1mol,通过还原反应制得氯气的质量为1mol×71g/mol=71g,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;71;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为dc,故答案为:dc;
(3)①根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2),
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,溶液为碱性,pH(NaCN)>pH(NaF),故NaCN溶液碱氢离子浓度较小,含有阴阳离子总数较小,即NaF溶液中阴阳离子总数较大,
故答案为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,
Fe2+最后沉淀,沉淀完全时该浓度为10-5mol?L-1,此时的S2-的浓度为
mol/L=6.3×10-13mol/L,
故答案为:CuS;6.3×10-13mol/L.
| 1 |
| 5 |
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;71;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为dc,故答案为:dc;
(3)①根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2),
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,溶液为碱性,pH(NaCN)>pH(NaF),故NaCN溶液碱氢离子浓度较小,含有阴阳离子总数较小,即NaF溶液中阴阳离子总数较大,
故答案为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,
Fe2+最后沉淀,沉淀完全时该浓度为10-5mol?L-1,此时的S2-的浓度为
| 6.3×10-18 |
| 10-5 |
故答案为:CuS;6.3×10-13mol/L.
点评:本题以学生比较陌生的亚氯酸钠制备为载体,考查学生阅读题目获取信息的能力、氧化还原反应计算、物质分离提纯、盐类水解、溶度积的有关计算与应用等,是在新情境下综合运用知识解决问题的能力的考查,题目有一定的难度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作或事故处理中,正确的做法是( )
| A、银镜反应实验后附着银的试管,可用稀H2SO4清洗 |
| B、在中学“硫酸铜晶体中结晶水含量测定”的实验中,称量操作至少需要三次 |
| C、不慎将浓H2SO4溅在皮肤上,立即用NaOH溶液冲洗 |
| D、在500 mL烧杯中,加入216g水和24gNaOH固体,配制10%NaOH溶液 |
已知:①C(s)+
O2(g)═CO(g)△H=-110.5kJ/mol??
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol??
③H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol??
下列说法正确的是( )
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、将2.4 g碳完全转化为水煤气,然后再燃烧,整个过程△H=-78.7 kJ/mol?? |
| B、H的燃烧热为241.8 kJ/mol?? |
| C、由反应②可推知,CO具有还原性而没有氧化性 |
| D、由反应③可知,反应过程中转移5 mol电子且生成液态水时放出的热量小于604.5 kJ |
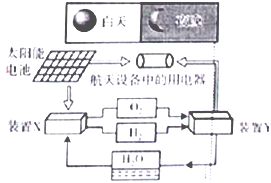 如图是一种航天器能量储存系统原理示意图.下列说法正确的是
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
由环己烷、乙醇、乙醚组成的混合物,经测定碳的质量分数为72%,则氧的质量分数为( )
| A、19.6% | B、17.8% |
| C、16% | D、14.2% |
 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A、5.4g水中含氢原子数为0.3NA |
| B、25℃,1L pH=12的氨水中,含有OH-的数目为0.1 NA |
| C、标准状况下,32g硫(结构如图)含S-S的数目为NA |
| D、在反应KIO3+6HI=3I2+KI+3H2O中,每生成l mol I2转移电子数为2 NA |
下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A、H+、Fe2+、Cr2O72-、SO42- |
| B、Al3+、Na+、SO42-、HCO3- |
| C、Na+、Cu2+、Cl-、S2- |
| D、Fe3+、K+、SCN-、Cl- |
下列化学用语或说法正确的是( )
| A、向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| B、向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、由水电离的c(H+)为10-13mol/L的溶液,Na+、NO3-、SO42-、I-一定能大量共存 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |