题目内容
11.A、B、C、D均为短周期元素,他们的原子序数依次增大,B是构成物质种类最多的元素,B和A组成的化合物 B6A6是一种无色透明的液体,不溶于水,密度比水小,C 是地壳中含量最高的非金属元素,D 在同周期元素中原子半径最大.(1)A、B、D 的元素名称分别为氢、碳、钠.
(2)C 在元素周期表中位置为第二周期第ⅦA族.
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为
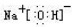 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为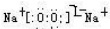 .
.(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式2NaH+O2=2NaOH.
分析 B元素形成的化合物种类最多,则B为碳元素;B和A组成的化合物 B6A6是一种无色透明的液体,不溶于水,密度比水小,所以A是氢;C 是地壳中含量最高的非金属元素,是氧元素,A、B、C、D均为短周期元素,他们的原子序数依次增大,D在同周期元素中原子半径最大,所以D是钠,由此分析解答.
解答 解:B元素形成的化合物种类最多,则B为碳元素;B和A组成的化合物 B6A6是一种无色透明的液体,不溶于水,密度比水小,所以A是氢;C 是地壳中含量最高的非金属元素,是氧元素,A、B、C、D均为短周期元素,他们的原子序数依次增大,D在同周期元素中原子半径最大,所以D是钠,
(1)A、B、D 的元素名称分别为氢、碳、钠,故答案为:氢、碳、钠;
(2)氧元素在元素周期表中位置为第二周期第ⅦA 族,故答案为:第二周期第ⅦA 族;
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为氢氧化钠,电子式为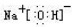 ;既含有非极性共价键又含有离子键的化合物为过氧化钠,电子式为:
;既含有非极性共价键又含有离子键的化合物为过氧化钠,电子式为: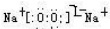 ,故答案为:
,故答案为: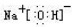 ;
;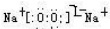 ;
;
(4)A 和 D 能组成一种化学活性很高的离子化合物NaH,NaH 能和C的单质氧气反应生成一种强碱,反应的化学方程式为:2NaH+O2=2NaOH,故答案为:2NaH+O2=2NaOH.
点评 本题考查结构性质位置关系应用、物质推断等,推断元素是解题关键,侧重对化学用语的考查,注意对基础知识的理解掌握.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
1.下列有关阿伏加德罗常数(NA)的说法中不正确的是( )
| A. | 0.1 mol•L-1 Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA | |
| B. | NaCl的沸点为1465℃,1500℃时气体摩尔体积是Vm,此状态下,3Vm L的氯化钠含有3 NA个共价键 | |
| C. | 25℃,1 L pH=1的稀硫酸中含有的H+数为0.1 NA | |
| D. | 1 mol Cu和足量稀硝酸反应产生$\frac{2}{3}$ NA个NO分子 |
2.为实现下列实验目的,下表提供的主要仪器以及所用试剂均合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
6.用均滴有酚酞试液和氯化钠溶液的滤纸分别制作甲、乙两个装置.下列描述正确的是( )
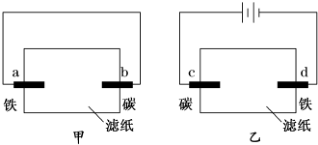

| A. | 滤纸上的阴离子都向碳棒迁移 | B. | a、d两极的电极反应式相同 | ||
| C. | b、d两极附近的溶液都变红 | D. | c、d两极均有少量气体产生 |
16.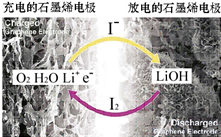 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
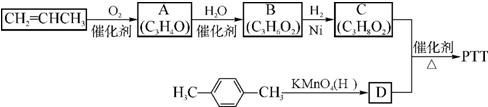
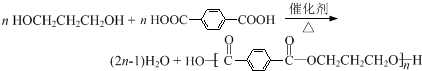 ,反应类型为缩聚反应.
,反应类型为缩聚反应.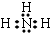 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.