题目内容
3.A、B和C为短周期元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等.回答下列问题:(1)A、B和C分别为氧、氮、氢或铍(用元素名称表示).
(2)由以上元素组成的化合物中,属于离子化合物的是NH4NO3,属于共价化合物的是HNO3.(各写一种即可)
(3)B的常见气态氢化物的电子式为
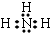 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
分析 A、B和C为短周期元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,则A为O元素;B是空气中含量最高的元素,则B为N元素;C最外层电子数与电子层数相等,原子序数小于氮,故C为Be或H.
解答 解:(1)A、B和C为短周期元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,则A为O元素;B是空气中含量最高的元素,则B为N元素;C最外层电子数与电子层数相等,原子序数小于氮,故C为Be或H,
故答案为:氧;氮;氢或铍;
(2)由以上元素组成的化合物中,属于离子化合物的是:NH4NO3等,属于共价化合物的是HNO3等,
故答案为:NH4NO3;HNO3;
(3)B的常见气态氢化物为NH3,电子式为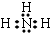 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子为NH4+,含有共价键、配位键,该离子氯化物的水溶液中,铵根离子水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性,
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子为NH4+,含有共价键、配位键,该离子氯化物的水溶液中,铵根离子水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性,
故答案为: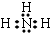 ;共价键、配位键,酸,NH4++H2O?NH3•H2O+H+.
;共价键、配位键,酸,NH4++H2O?NH3•H2O+H+.
点评 本题考查结构性质位置关系应用,关键是推断元素,熟练掌握元素化合物性质与结构,比较基础.

练习册系列答案
相关题目
13.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| C. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 | |
| D. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 |
14.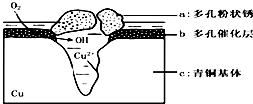 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极b被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH)3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O═4OH-- |
18.下列两种化合物的结构或性质描述正确的是( )
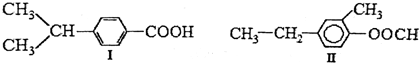
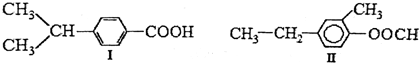
| A. | 两种物质的分子式均为C10H14O2互为同分异构体 | |
| B. | 两种物质均能发生加成和取代反应 | |
| C. | 两种物质都有甲基、苯环和羧基 | |
| D. | 两物质都含有双键因此都能使溴的四氯化碳溶液褪色 |
8.下列排序不正确的是( )
| A. | 离子半径:Cl-<Mg2+<Na+ | B. | 非金属性:Si<C<N | ||
| C. | 碱性:Mg(OH)2<NaOH<KOH | D. | 稳定性:PH3<NH3<H2O |
8. 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | |
| B. | R与Q的电子数相差18 | |
| C. | 气态氢化物稳定性:R<T<Q | |
| D. | 最高价氧化物对应水化物的酸性:T>Q |
9.NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得.工艺流程如图:
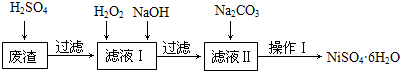
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
注:NiCO3是一种不溶于水易溶于强酸的沉淀.
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.
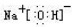 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为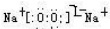 .
.