题目内容
1.为确定某溶液中是否存在Cl-、SO42-和CO32-,进行如下实验①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀.
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解.
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是( )
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定SO42- 是否存在 |
分析 ①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀,白色沉淀为碳酸钡或硫酸钡;
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体,气体为二氧化碳;白色沉淀部分溶解,可知白色沉淀为碳酸钡和硫酸钡;
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀,白色沉淀为AgCl,但②中加盐酸引入氯离子,以此来解答.
解答 解:①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀,白色沉淀为碳酸钡或硫酸钡;
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体,气体为二氧化碳;白色沉淀部分溶解,可知白色沉淀为碳酸钡和硫酸钡;
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀,白色沉淀为AgCl,但②中加盐酸引入氯离子,则不能确定是否含Cl-,
综上所述,一定含SO42-和CO32-,不能确定是否含Cl-,
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、现象与结论为解答的关键,侧重分析与实验能力的考查,注意加盐酸引入氯离子,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
9.设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 过氧化钠用作呼吸面具中的供氧剂,每生成0.1molO2,转移电子的数目为0.4NA | |
| B. | 将1mL1mol/LFeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| C. | 标准状况下,0.1molCl2溶于水,转移电子的数目为0.1NA | |
| D. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA |
16.下列有关物质的性质说法正确的是( )
| A. | 碳酸氢钠比碳酸钠热稳定强 | |
| B. | Na2O2可用作供氧剂 | |
| C. | K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 | |
| D. | 打磨过的铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
6.常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到PH=7 的溶液,混合时硫酸酸与NaOH溶液的体积比为( )
| A. | 1:200 | B. | 200:1 | C. | 100:1 | D. | 1:100 |
13.血液的常规检测中,测得某同学葡萄糖的浓度是2.52mmol•L-1,总胆红素的浓度是9.2μmol•L-1.葡萄糖浓度的正常范围是3.61~6.11mmol•L-1,总胆红素浓度的正常范围是0~19μmol•L-1.下列说法正确的是( )
| A. | 该同学的葡萄糖的浓度偏高 | |
| B. | 该同学的葡萄糖的浓度比总胆红素的浓度高 | |
| C. | 该同学的总胆红素的浓度比葡萄糖的浓度高 | |
| D. | 该同学的总胆红素的浓度出现异常 |
16. 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
(4)欲提高SO2的反应速率和转化率,下列措施可行的是B(填选项字母).
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
 硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途.回答下列问题:(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;该反应在沸腾炉(填设备名称)中进行.
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2,SO3进入吸收塔(填设备名称)中用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如表所示.已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是400℃,1个标准大气压
| 压强 SO2转化率 温度 | 1.0×105Pa | 5.0×105Pa | 1.0×106Pa | 1.5×106Pa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
A.向装置中通入氮气且保持体积不变
B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500μL•L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
17.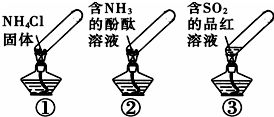 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,②溶液褪色或红色变浅,冷却后又都变为红色 | |
| C. | 加热时,③溶液褪色或红色变浅,冷却后又都变为红色 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
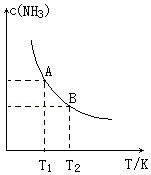 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.