题目内容
12.括号中的物质是杂质,在横线上写出除去这些杂质的试剂,并写出发生的离子方程式(1)MgO(Al2O3):试剂NaOH离子方程式Al2O3+2OH-═2AlO2-+H2O
(2)FeCl3(FeCl2):试剂氯气离子方程式2Fe2++Cl2═2Fe3++2Cl-
(3)NaHCO3(Na2CO3):试剂足量二氧化碳离子方程式CO2+CO32-+H2O=2HCO3-.
分析 氧化铝与NaOH反应,而MgO不能;
氯气与氯化亚铁反应生成氯化铁;
碳酸钠与二氧化碳、水反应生成碳酸氢钠,以此来解答.
解答 解:(1)氧化铝与NaOH反应,而MgO不能,除杂试剂为NaOH,离子反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;
(2)氯气与氯化亚铁反应生成氯化铁,除杂试剂为氯气,离子反应为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:氯气;2Fe2++Cl2═2Fe3++2Cl-;
(3)碳酸钠与二氧化碳、水反应生成碳酸氢钠,除杂试剂为足量二氧化碳,离子反应为CO2+CO32-+H2O=2HCO3-,
故答案为:足量二氧化碳;CO2+CO32-+H2O=2HCO3-.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.元素的性质随着原子序数的递增呈现周期性变化的根本原因是( )
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
3.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上的气态化合物,则下列说法错误的是( )
| A. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有4种 | |
| B. | X、Y、Z可以形成离子化合物 | |
| C. | Y和Z分别形成的简单离子,其离子半径为Y>Z | |
| D. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
20.下列溶液中c(Cl-)与50mL 1mol/L氯化铝溶液中c(Cl-)相等的是( )
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化铜溶液 |
17.下列关于有机物的命名中不正确的是( )
| A. | 2,2二乙基戊烷 | B. | 3甲基己烷 | C. | 3,4二甲基辛烷 | D. | 3甲基庚烷 |
1.为确定某溶液中是否存在Cl-、SO42-和CO32-,进行如下实验
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀.
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解.
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是( )
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀.
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解.
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是( )
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定SO42- 是否存在 |
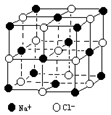 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl晶体结构如图所示.
 .
.