题目内容
11.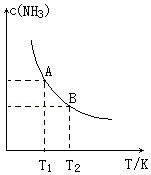 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,发生反应为:N2(g)+3H2(g)?2NH3(g)△H=a kJ/mol,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为33.3%.①上述反应中的a<0.(填“>”、“<”或“=”)
②该反应在T1温度下5.00min达到平衡,此时N2的转化率为50%.
③在T1温度下该反应的化学平衡常数K1=0.593.
分析 ①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,而升高温度平衡向吸热反应移动,据此分析;
②将1.00molN2(g)与3.00molH2(g)混合于一个1.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为33.3%,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以$\frac{2n}{4-2n}$=33.3%,解得n=0.5
根据N2的转化率=$\frac{消耗的氮气物质的量}{氮气起始物质的量}$×100%;
③根据K1=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$计算平衡常数;
解答 解:①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,而升高温度平衡向吸热反应移动,故正反应为放热反应,则a<0,
故答案为:<;
②将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以$\frac{2n}{4-2n}$=33.3%,解得n=0.5
根据N2的转化率=$\frac{消耗的氮气物质的量}{氮气起始物质的量}$×100%=$\frac{0.5mol}{1mol}$×100%=50%,
故答案为:50%;
③T1温度下该反应的化学平衡常数K1=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$=$\frac{1{\;}^{2}}{0.5×1.5{\;}^{3}}$≈0.593,
故答案为:0.593;
点评 本题考查化学平衡的判断、平衡常数计算及应用,难度中等,注意理解三组量法解平衡计算的应用.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
| A. | 氯化钡溶液和盐酸 | B. | 硝酸银溶液和硝酸 | ||
| C. | 氯化钡溶液和硝酸银溶液 | D. | 硝酸钡溶液和硝酸银溶液 |
| A. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有4种 | |
| B. | X、Y、Z可以形成离子化合物 | |
| C. | Y和Z分别形成的简单离子,其离子半径为Y>Z | |
| D. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 |
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化铜溶液 |
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀.
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解.
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验,以下推测不正确的是( )
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定SO42- 是否存在 |
 某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题
某反应由两步反应 A、B、C 构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).回答下列问题