题目内容
9.已知空气组成( 体积分数 ) N2 0.800 O2 0.200氨空气氧化后的混合气体组成如下( 高温下NO与O2可以共存 )
NO 16mol O2 7.00mol H2O 24.5mol N2 112mol
完成下列计算:
(1)该混合气体中NO全部转化为HNO3 需要5摩尔O2.
(2)参加反应的空气的体积是3136升.( 标准状况下 )
(3)向该混合气体中添加空气使NO完全转化为HNO3,转化后剩余气体中(不含H2O)氧气体积分数为0.0500.添加空气多少摩尔?
(4)该混合气体的组成表明NH3氧化产生的NO超过16mol,有部分NO已和O2、H2O反应转化为HNO3.这部分NO是多少摩尔?
分析 (1)NO完全转化为硝酸,发生反应:4NO+3O2 +2H2O=4HNO3,据此计算需要氧气总物质的量,减去混合气体中氧气物质的量即为需要加入的氧气;
(2)氮气不参加反应,结合氮气体积分数计算通入空气体积;
(3)剩余气体为氮气、氧气混合气体,假设需要通入空气为xmol,表示混转化后氮气物质的量,根据方程式计算参加反应氧气物质的量,进而表示出剩余氧气物质的量,利用体积分数列方程计算;
(4)反应过程中氮气的量不变,结合氮气体积分数计算原空气中氧气物质的量,根据4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O计算参加反应的氧气,计算反应4NO+3O2 +2H2O=4HNO3中消耗的氧气,进而计算转化为HNO3的NO.
解答 解:(1)NO完全转化为硝酸,发生反应:4NO+3O2 +2H2O=4HNO3,需要氧气总物质的量为16mol×$\frac{3}{4}$=12mol,减去混合气体中氧气物质的量即为需要加入的氧气,故需要加入的氧气为12mol-7mol=5mol,故答案为:5;
(2)氮气不参加反应,N2 的体积分数为0.800,故通入空气体积为$\frac{112mol}{0.8}$×22.4L/mol=3136L,故答案为:3136;
(3)剩余气体为氮气、氧气混合气体,假设需要通入空气为xmol,表示混转化后氮气物质的量为112mol+0.8x mol,4NO+3O2 +2H2O=4HNO3,需要氧气总物质的量为16mol×$\frac{3}{4}$=12mol,则剩余氧气为0.2x mol+7mol-12mol=(0.2x-5)mol,则$\frac{0.2x-5}{112+0.8x+0.2x-5}$=0.05,解得x=69,
答:添加空气为69mol;
(4)空气中氮气与氧气的物质的量比4:1,反应过程中氮气的量不变,原来氧气的物质的量为112mol×$\frac{1}{4}$=28mol,由4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O可知,生成16molNO消耗氧气为16mol×$\frac{5}{4}$=20mol,则4NO+3O2 +2H2O=4HNO3中消耗氧气为28mol-7mol-20mol=1mol,由方程式可知转化为硝酸的这部分NO为1mol×$\frac{4}{3}$=$\frac{4}{3}$mol,
答:转化为硝酸的这部分NO为$\frac{4}{3}$mol.
点评 本题考查混合物计算、化学方程式计算,是对学生综合能力的考查,明确发生的反应是关键,难度中等.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案| 选项 | 物质 | 说法 | 解释 |
| A | 氯化镁 | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba2+无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
| A. | 该溶液中Na+、NH4+、CO32-、Cl-可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 与Na2S反应的离子方程式:Al3++S2-→Al2S3↓ | |
| D. | 与过量浓氨水反应的离子方程式:Al3++3NH3+3H2O→Al(OH)3↓+3NH4+ |
| A. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| B. | 1mol Cl2参加反应,转移电子数一定为2NA | |
| C. | 标准状况下,2.24 L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| D. | 0.5 mol O3与11.2 LO2所含的分子数一定相等 |
| A. | 用Cu片作阳极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+H2↑+2OH- | |
| B. | 用两个铜片作电极电解AgNO3溶液:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$Ag+O2+4H+ | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
 .
.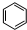 +HNO3$→_{50-60℃}^{浓硫酸}$
+HNO3$→_{50-60℃}^{浓硫酸}$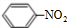 +H2O,反应类型取代反应.
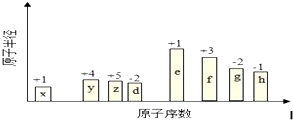
+H2O,反应类型取代反应.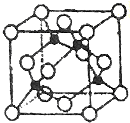 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题: