题目内容
4.下列有关Al2(SO4)3溶液的叙述正确的是( )| A. | 该溶液中Na+、NH4+、CO32-、Cl-可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 与Na2S反应的离子方程式:Al3++S2-→Al2S3↓ | |
| D. | 与过量浓氨水反应的离子方程式:Al3++3NH3+3H2O→Al(OH)3↓+3NH4+ |
分析 A、铝离子与碳酸根离子发生双水解;
B、硫酸铝是酸性溶液与二氧化碳不反应;
C、Al2S3在溶液中不能存在;
D、氢氧化铝不溶于氨水.
解答 解:A、铝离子与碳酸根离子发生双水解生成氢氧化铝和二氧化碳气体,而不能共存,故A错误;
B、硫酸铝是酸性溶液与二氧化碳不反应,无白色沉淀,故B错误;
C、Al2S3在溶液中不能存在,所以Al2(SO4)3溶液与Na2S溶液混合双水解生成氢氧化铝和硫化氢气体,故C错误;
D、氢氧化铝不溶于氨水,所以反应的离子方程式为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查离子共存和盐类水解的应用,把握常见的盐的类别,学生注意硫酸铝是酸性溶液与二氧化碳不反应,题目较简单.

练习册系列答案
相关题目
14.下列物质既能与金属钠反应放出气体,又能与纯碱作用放出气体的是( )
| A. | CH3CH2OH | B. | H2O | C. | C6H12O6 | D. | CH3COOH |
15.X、Y、Z、W四种原子序数依次增大的短周期主族元素,X原子的质子数是内层电子数的4倍,Y原子半径是短周期主族元素中最大的,X原子与W原子电子总数是Z原子电子数的2倍,W与X同主族.下列说法正确的是( )
| A. | X、W的最外层电子数均为6 | B. | 最高价氧化物的水化物的碱性:Y>Z | ||
| C. | 简单气态氢化物的稳定性:W>X | D. | Y的单质在X的单质中燃烧生成Y2X |
12.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图: .写出元素Z的简单气态氢化物的电子式:
.写出元素Z的简单气态氢化物的电子式: .
.
(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式:KOH+Al(OH)3=KAlO2+2H2O.
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是Al(填元素符号,下同);元素T与氯化素相比,非金属性较强的是F,下列表述中能证明这一事实的是c(填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.
| 元素 | 元素性质或原子的结构 |
| T | 2p轨道能级电子数比s能级电子数多1个 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
 .写出元素Z的简单气态氢化物的电子式:
.写出元素Z的简单气态氢化物的电子式: .
.(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式:KOH+Al(OH)3=KAlO2+2H2O.
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是Al(填元素符号,下同);元素T与氯化素相比,非金属性较强的是F,下列表述中能证明这一事实的是c(填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.
19.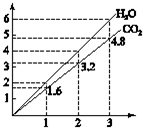 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①可能有C2H4 ②一定没有C2H6 ③一定有C3H8
④一定有CH4 ⑤可能有C2H6 ⑥可能有C2H2.
 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )①可能有C2H4 ②一定没有C2H6 ③一定有C3H8
④一定有CH4 ⑤可能有C2H6 ⑥可能有C2H2.
| A. | ②⑤⑥ | B. | ④⑥ | C. | ①②④ | D. | ②③ |
16.下列4种变化中,有一种变化与其它3种变化类型不同的是( )
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | CH3CH2OH+HBr$\stackrel{△}{→}$C2H5Br+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O | |
| D. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl |
13.某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为( )
| A. | HXO | B. | H2XO3 | C. | HXO3 | D. | H2XO4 |